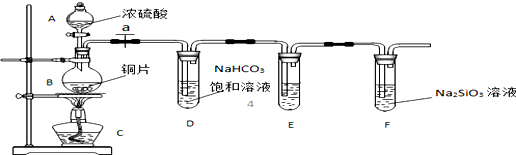
题目内容
20.(1)下列实验操作中,叙述正确的是GH(填字母)A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏小
B.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌
C.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另-烧杯
D.做焰色反应的铂丝,用硫酸洗涤后,再在酒精灯火焰上灼烧至无色,才可使用
E.向溶液中加盐酸酸化的BaCl2,如果产生白色沉淀,则一定有SO42-
F.证明某盐中含有NH4+的方法是:取该盐加入强碱溶液加热,如果产生使湿润的蓝色石蕊试纸变红的气体,便证明有NH4+
G.除去硝酸钾固体中混有的少量氯化钾,所进行的实验步骤依次是:配成较高温度下的浓溶液、降温结晶、过滤
H.用灼烧法鉴别棉织品和毛织品,有焦臭味的是毛织品
(2)有一固体粉末,可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验.①将该粉末溶于水得无色溶液和白色沉淀;②在滤出的沉淀中加入稀硝酸,部分沉淀溶解,同时产生无色气体;③取滤液做焰色反应,可以看到黄色火焰,透过蓝色钴玻璃片,观察不到紫色火焰.由上述现象可推断:一定有Na2CO3、Na2SO4、Ba(NO3)2
(3)、实验室为完成某一实验,需用240mL 0.1mol/L 的Na2CO3溶液,现用Na2CO3﹒10H2O晶体配制.请据此回答下列问题:
(1)实验时,应用托盘天平称取十水碳酸钠晶体7.2 g.
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有烧杯、玻璃棒、胶头滴管、250mL容量瓶.
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是BD.(填字母)
A.容量瓶内壁附有水珠而未干燥处理
B.忘记将洗涤液加入容量瓶
C.定容时俯视刻度线
D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切
E.溶液注入容量瓶前没有恢复到室温就进行定容
F.Na2CO3•10H2O已失去部分结晶水
(4)取配好的碳酸钠溶液10毫升,加水稀释到50毫升,稀释后碳酸钠溶液的物质的量浓度为0.02 mol/L.
分析 (1)A.不能用蒸馏水润湿试纸,但若湿润,测定NaCl的pH也无影响;
B.玻璃棒不能在过滤器内搅拌;
C.分液时,避免上下层液体混合;
D.焰色反应的铂丝,用盐酸洗涤;
E.加盐酸酸化的BaCl2,产生白色沉淀可能为AgCl;
F.氨气使湿润的红色石蕊试纸变蓝;
G.硝酸钾的溶解度受温度影响大,而KCl的溶解度受温度影响不大;
H.毛织品的成分为蛋白质,灼烧有焦臭味;
(2)①将该粉末溶于水得无色溶液和白色沉淀,则一定不含CuCl2,沉淀为碳酸钡或硫酸钡,则一定含Ba(NO3)2;
②在滤出的沉淀中加入稀硝酸,部分沉淀溶解,同时产生无色气体,则沉淀为碳酸钡、硫酸钡的混合物,;
③取滤液做焰色反应,可以看到黄色火焰,透过蓝色钴玻璃片,观察不到紫色火焰,则一定含Na2CO3、Na2SO4,不一定含NaCl,一定不含K2CO3、K2SO4.
(1)需要240mL溶液,应该选用250mL容量瓶,实际上配制的是250mL 0.1mol/L的碳酸钠溶液,根据m=nM=cVM计算需要十水碳酸钠晶体;
(2)根据实验操作的步骤以确定溶液配制所需仪器;
(3)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(4)根据c1V1=c2V2计算出稀释后碳酸钠溶液的物质的量浓度.
解答 解:(1)A.不能用蒸馏水润湿试纸,但若湿润,测定NaCl的pH也无影响,则先用蒸馏水润湿试纸可能会导致测定结果偏小,故A错误;
B.玻璃棒不能在过滤器内搅拌,易将滤纸捣破,起不到过滤作用,故B错误;
C.分液时,避免上下层液体混合,则分液漏斗中下层液体从下口放出后,然后上层液体从上口倒出,故C错误;
D.焰色反应的铂丝,用盐酸洗涤,硫酸不挥发,干扰实验,故D错误;
E.加盐酸酸化的BaCl2,产生白色沉淀可能为AgCl,则不一定有SO42-,故E错误;
F.氨气使湿润的红色石蕊试纸变蓝,则检验方法中试纸不合理,故F错误;
G.硝酸钾的溶解度受温度影响大,而KCl的溶解度受温度影响不大,则配成较高温度下的浓溶液、降温结晶、过滤可得到硝酸钾,故G正确;
H.毛织品的成分为蛋白质,灼烧有焦臭味,则用灼烧法鉴别棉织品和毛织品,故H正确;
故答案为:GH;
(2)①将该粉末溶于水得无色溶液和白色沉淀,则一定不含CuCl2,沉淀为碳酸钡或硫酸钡,则一定含Ba(NO3)2;
②在滤出的沉淀中加入稀硝酸,部分沉淀溶解,同时产生无色气体,则沉淀为碳酸钡、硫酸钡的混合物,;
③取滤液做焰色反应,可以看到黄色火焰,透过蓝色钴玻璃片,观察不到紫色火焰,则一定含Na2CO3、Na2SO4,不一定含NaCl,一定不含K2CO3、K2SO4,
综上所述,一定含Na2CO3、Na2SO4、Ba(NO3)2,
故答案为:Na2CO3、Na2SO4、Ba(NO3)2.
(1)实验室没有240mL容量瓶,需要选用250mL容量瓶配制溶液,需要碳酸钠的物质的量为:0.1mol/L×0.25L=0.025mol,需要十水碳酸钠晶体的质量为:0.025mol×286g/mol=7.15g,需要称量7.2g十水碳酸钠晶体,
故答案为:7.2;
(2)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的玻璃仪器为:250mL容量瓶、胶头滴管,
故答案为:胶头滴管;250mL容量瓶;
(3)A.容量瓶内壁附有水珠而未干燥处理,容量瓶中少量的水对溶质的物质的量及溶液的体积没有影响,不影响配制结果,故A错误;
B.忘记将洗涤液加入容量瓶,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,故C错误;
D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切,导致配制的溶液体积偏大,配制的溶液浓度偏低,故D正确;
E.溶液注入容量瓶前没有恢复到室温就进行定容,热的溶液体积偏大,冷却后体积变小,导致配制的溶液体积偏小,溶液浓度偏高,故E错误;
F.Na2CO3•10H2O已失去部分结晶水,导致称量的碳酸钠的物质的量偏大,配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故F错误;
故答案为:BD;
(4)取配好的碳酸钠溶液10毫升,加水稀释到50毫升,稀释过程中溶质的物质的量不变,则稀释后碳酸钠溶液的物质的量浓度为:
c=$\frac{0.1mol/L×10×1{0}^{-3}L}{50×1{0}^{-3}L}$=0.02mol/L,
故答案为:0.02.
点评 本题考查化学实验方案的评价,为高频考点,涉及知识点较多,侧重实验基本操作和物质推断的考查,把握混合物分离方法及操作、离子的检验及焰色反应等为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

| A. | 热稳定性:NH3<PH3<H2O | |
| B. | P元素最高价氧化物对应的水化物酸性比Cl的强 | |
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 元素非金属性:O>F |
| A. | 酸性由强到弱的顺序为HCN>HClO>CH3COOH | |
| B. | 0.1mol?L-1 NaClO溶液的碱性一定比0.1 mol?L-1 CH3COONa强 | |
| C. | 等物质的量浓度的CH3COONa溶液和醋酸溶液都促进了水的电离 | |
| D. | a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合,溶液中c(Na+)=c(CN-),则a=b |
| A. | N2的电子式: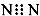 | B. | 钠离子的结构示意图: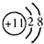 | ||
| C. | 乙烯的结构式:C2H4 | D. | CO2的比例模型: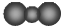 |
| A. | 离子半径:Na+>O2->F- | B. | 最高正价:F>O>N | ||
| C. | 电负性:S<Cl<F | D. | 第一电离能:Na<Mg<Al |
| A. | NaOH溶液 | B. | 饱和Na2CO3溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和氯化钠溶液 |
| A. | K+、Ba2+、NO3-、HCO3- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | K+、NH4+、SO42-、OH- | D. | H+、Na+、CO32-、SO42- |
| A. | 没有氧元素参加的反应一定不是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 有单质生成的分解反应一定是氧化还原反应 |