题目内容
10.下列说法正确的是( )| A. | 没有氧元素参加的反应一定不是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 有单质生成的分解反应一定是氧化还原反应 |
分析 A.存在元素化合价的变化的反应是氧化还原反应;
B.某元素从化合态变为游离态时,该元素不一定被还原;
C.氧化剂被还原,还原剂被氧化;
D.有单质生成的分解反应存在化合价的变化属于氧化还原反应.
解答 解:A.存在元素化合价的变化的反应是氧化还原反应,氧化还原反应中不一定有氧元素参加,如氢气与氯气的反应属于氧化还原反应,但是没有氧元素参加,故A错误;
B.某元素在化合态中可能显正价,也可能显负价,故当变为游离态时,该元素可能被还原,也可能被氧化,故B错误
C.氧化剂被还原,还原剂被氧化,故C错误;
D.有单质生成的分解反应,元素的化合价一定发生变化,属于氧化还原反应,故D正确.
故选D.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,解答本题时注意能结合物质的性质,难度不大.

练习册系列答案
相关题目
1.已知NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 常温常压下,1mol苯分子中含有碳氢单键数为6NA | |
| B. | 52g C2H2中含有的共用电子对数为10NA | |
| C. | 标准状况下,2.24 L乙烯和丙烯混合气体中含有5NA氢原子 | |
| D. | 标准状况下,2.24 L溴乙烷中含溴原子数目大于0.1NA |
18.下列反应中属于氧化还原反应的是( )
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CuO+2HCl═CuCl2+H2O | ||
| C. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | D. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO |
15.对于反应中的能量变化,表述正确的是( )
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 断开化学键会放出能量 |
19.下列装置或操作能达到实验目的是( )
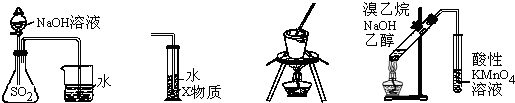

| A. | 装置①可用于证明SO2与NaOH溶液发生了反应 | |
| B. | 装置②中X为CCl4,可用于吸收氨气或氯化氢 | |
| C. | 装置③可用于实验室从食盐水中提取氯化钠 | |
| D. | 装置④可用于证明溴乙烷与NaOH醇溶液共热生成乙烯 |

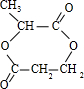
 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基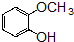
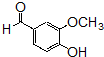 的同分异构体的结构简式
的同分异构体的结构简式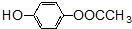
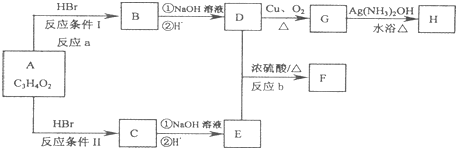
 +2H2O
+2H2O