题目内容
1.下列说法中不正确的有几个( )①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质;
③固态的冰醋酸不导电,液态的纯醋酸可以导电;
④NaHSO4电离时生成的阳离子有氢离子,所以是酸;
⑤电解质放在水中一定能导电.非电解质放在水中一定不导电.
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 ①非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;
②依据电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质在水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
③依据非金属石墨、金属单质和在熔融状态下的电解质以及其溶液都能导电;
④能电离出的阳离子全部是H+的化合物叫做酸;
⑤依据电解质与溶液导电的关系进行解答.
解答 解:①BaSO4固体没有自由移动的离子不导电; 虽然硫酸钡在水中的溶解度很小,只要溶解就完全电离,硫酸钡在熔融状态下,能完全电离,所以硫酸钡是电解质,故①错误;
②氨气只存在分子,不能导电;NH3在水溶液里,生成一水合氨,一水合氨能电离出自由移动的铵根离子和氢氧根离子导致导电,不是氨气自身电离,所以氨气是非电解质,故②错误;
③电解质在水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;固态的冰醋酸不导电,液态的纯醋酸只有乙酸分子,不能导电,故③错误;
④电离出的阳离子全部是H+的化合物叫做酸,能电离出H+的化合物不一定是酸,硫酸氢钠能电离出氢离子,NaHSO4=Na++H++SO42-,属于盐,故④错误;
⑤电解质放在水中不一定能导电,如碳酸钙固体在水中的溶解度很小,难溶于水,几乎没有自由移动的离子,几乎不导电;碳酸钙在熔融状态下,能完全电离,碳酸钙是电解质;非电解质放在水中不一定不导电,如NH3在水溶液里,生成一水合氨,一水合氨能电离出自由移动的铵根离子和氢氧根离子导致导电,氨气自身未电离,所以氨气是非电解质,故⑤错误;
故选D.
点评 本题重点考查了电解质、非电解质概念的辨析、电解质与导电的关系的判断,抓住电解质必须是化合物,电解质导电是存在自由移动的离子是解答本题的关键,题目难度不大.

| A. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L | |
| B. | 从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液中氢离子的浓度为4mol/L | |
| C. | 配制100mL0.5 mol/L的NaCl溶液,需用托盘天平称取食盐2.9g | |
| D. | 中和100mL 1mol/L的H2SO4溶液,需NaOH为8g |
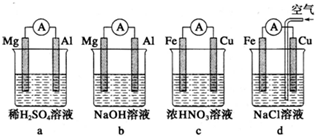
| A. | 实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发 | |
| B. | 常将钠保存在煤油中 | |
| C. | 新制氯水应密封保存在棕色试剂瓶中 | |
| D. | 取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色 |
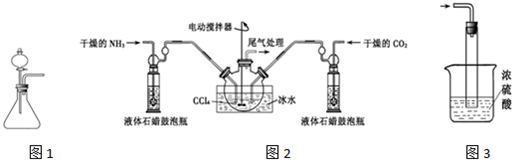
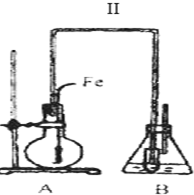 色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.
色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.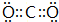 ;V原子的结构示意图
;V原子的结构示意图 ;Z的氢化物结构式为
;Z的氢化物结构式为 ;写出U元素在周期表中的位置第三周期VIA族;N2W2中含有的化学键有离子键、共价键(化学键类型)
;写出U元素在周期表中的位置第三周期VIA族;N2W2中含有的化学键有离子键、共价键(化学键类型)