题目内容
【题目】(1)基态Fe2+的核外电子排布式为_________________________________。
(2)元素的第三电离能I3:Fe______Mn(填“>”或:“<”)。
(3)H2O的沸点比H2S高的原因是_______________________________________。
(4)亚西尔阿拉法特的死因被怀疑是钋—210中毒。钋与氧同族,基态钋原子有________个未成对电子。钋沉积在铍(9Be)上用作原子弹的中子源。铍的氯化物BeCl2室温下为雪白色易升华的固体,能溶于水和部分有机溶剂。室温下BeCl2固体属于__________晶体,500-600°C时,氯化铍以二聚体的形式存在,其二聚体的结构式为__________________(配位键用“→”表示)。
(5)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
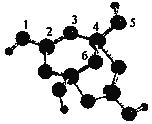
①在Xm-中,数字标号为4的硼原子的轨道杂化类型为___________;m=_______填数字)。
②若硼砂的式量为382 , 则其化学式为______________。
【答案】1s22s22p63s23p63d6 <水分子之间能形成氢键而H2S分子之间不能形成氢键2分子晶体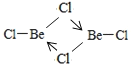 sp32Na2B4O5(OH)4 ·8H2O或Na2B4O7 ·10H2O或Na2 H4B4O9·8H2O
sp32Na2B4O5(OH)4 ·8H2O或Na2B4O7 ·10H2O或Na2 H4B4O9·8H2O
【解析】
根据核外电子排布规律书写;原子轨道处于半满、全满、全空时能量更低稳定;H2O分子间可以形成氢键;钋原子的外围电子排布式是6s26p4;易升华,溶于有机溶剂,说明该化合物形成的晶体是分子晶体;Be原子具有空轨道,氯原子具有孤对电子,可以形成配位键;依据价层电子对数判断杂化轨道类型;依据化合价代数和为零计算化学式;依据(H4B4O9)m-为(H4B4O9)2-、四硼酸钠的化学式为Na2B4O7和式量推断。
(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成
Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。(2)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为
3d54s2,由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的
3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5
半充满状态,需要的能量相对要少。(3)H2O与H2S都属于分子晶体,H2O分子间可以形成氢键,H2S只含有范德华力,所以水的沸点高于H2S的沸点。(4)钋原子的外围电子排布式是6s26p4,所以钋原子有2个未成对电子;BeCl2易升华,溶于有机溶剂,说明该化合物形成的晶体是分子晶体;BeCl2结构为Cl-Be-Cl,二聚体为氯原子的孤电子对提供给铍,所以(BeCl2)2结构简图为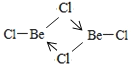 。(5)4号B形成4个键,价层电子对数为4,则B原子为SP3杂化;H可以形成1个共价键,O可以形成2个共价键,B可以形成3个共价键,所以最小的球为氢原子,共4个,颜色浅的大球为氧原子,共9个,颜色深的大球为硼原子,共4个,其化学式为(H4B4O9)m-,H为+1价,B为+3价,O为-2价,所以4×1+4×3-2×9=-m,得m=2;(H4B4O9)m-为(H4B4O9)2-,四硼酸钠的化学式为Na2B4O7,结合硼砂的式量为382可得四硼酸钠含有10个结晶水,则硼砂的化学式为Na2B4O7 ·10H2O。
。(5)4号B形成4个键,价层电子对数为4,则B原子为SP3杂化;H可以形成1个共价键,O可以形成2个共价键,B可以形成3个共价键,所以最小的球为氢原子,共4个,颜色浅的大球为氧原子,共9个,颜色深的大球为硼原子,共4个,其化学式为(H4B4O9)m-,H为+1价,B为+3价,O为-2价,所以4×1+4×3-2×9=-m,得m=2;(H4B4O9)m-为(H4B4O9)2-,四硼酸钠的化学式为Na2B4O7,结合硼砂的式量为382可得四硼酸钠含有10个结晶水,则硼砂的化学式为Na2B4O7 ·10H2O。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案