题目内容
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
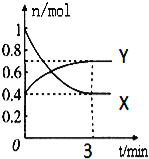
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
【答案】(1)X;(2)减慢;减慢;(3)甲; (4)0.05mol/(Lmin);(5)BCF.
【解析】试题分析:(1)由方程式2NO2(g) (红棕色)N2O4g)(无色),可知反应中NO2的物质的量变化较大,则X表示NO2的物质的量随时间的变化曲线;
(2)温度降低,正逆反应速率都减慢;
(3)分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),v(NO2)=2v(N2O4)=0.6molL-1min-1=0.01mol/(Ls),则甲反应较快;
(4)v(N2O4)=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(5)A.v(NO2)=2v(N2O4),未体现正与逆的关系,故错误;B.容器内压强不再发生变化,说明达平衡状态,故正确;C.X的体积分数不再发生变化,说明达平衡状态,故正确;D.容器内气体原子总数不再发生变化,从反应发生容器中原子总数就不变,所以不能作平衡状态的标志,故错误;E. 只要反应发生就符合相同时间内消耗n mol的Y的同时生成2n mol的X,所以不一定达平衡状态,故错误;F.相同时间内消耗n mol的Y的同时消耗2n mol的X,说明达平衡状态,故正确;故选BCF。







