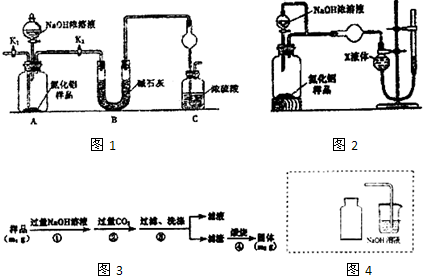
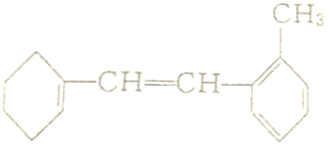题目内容
9.现有①NaCl②金刚石 ③Na ④NaHSO4⑤干冰 ⑥碘片六种物质,按要求回答下列问题(填序号):(1)属于离子化合物的是①④,只有离子键的物质是①,晶体以分子间作用力结合的是⑤⑥.
(2)NaHSO4熔融状态下电离,破坏了离子键,写出电离方程式NaHSO4(熔融)=Na++HSO4-
(3)判断①、②、③、⑤熔沸点高低顺序②>①>③>⑤.
分析 (1)一般活泼非金属元素与活泼金属元素形成离子键,离子化合物中一定含有离子键,可能含有共价键;分子晶体中分子间以分子间作用力结合;
(2)离子晶体在熔融时破坏离子键;
(3)熔沸点的一般规律:原子晶体>离子晶体>分子晶体,结合物质常温下的状态分析.
解答 解:(1)一般活泼非金属元素与活泼金属元素形成离子键,离子化合物中一定含有离子键,可能含有共价键,NaCl中只含有离子键,NaHSO4中含有离子键和共价键;分子晶体中分子间以分子间作用力结合,干冰和碘片属于分子晶体,以分子间作用力结合;
故答案为:①④;①;⑤⑥;
(2)离子晶体在熔融时破坏离子键,NaHSO4属于离子晶体熔融状态下电离出钠离子和硫酸氢根离子,则电离方程式为:NaHSO4(熔融)=Na++HSO4-;
故答案为:离子键;NaHSO4(熔融)=Na++HSO4-;
(3)熔沸点的一般规律:原子晶体>离子晶体>分子晶体,①NaCl属于离子晶体,②金刚石属于原子晶体 ③Na属于金属晶体,常温下为固体,其熔沸点低于NaCl,⑤干冰属于分子晶体,常温下为气体,则熔沸点高低顺:②>①>③>⑤.
故答案为:②>①>③>⑤.
点评 本题考查了化学键、晶体的类型、熔沸点的比较,根据晶体的构成微粒及微粒间的作用力来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.如图,铝电池(甲)性能优越,现用该电池给乙装置进行电解,以制备一种“绿色高效多功能”水处理剂,下列说法错误的是( )


| A. | 甲装置工作时,正极发生发应为3AgO+6e-+3H2O=3Ag+6OH-; | |
| B. | 若乙装置选用阴离子交换膜时,则电解完成后,右侧溶液中含有FeO42-; | |
| C. | 每制得1mol Na2FeO4,理论上甲装置中消耗2mol NaOH; | |
| D. | 乙装置若选用阴离子交换膜,电解一段时间后,右侧溶液PH下降(忽略溶液体积改变). |
20.比较下列各组物质的沸点 ①乙烷<乙醇②正戊烷<异戊烷 ③1-丁烯<1-庚烯④乙二醇<丙三醇,其中正确的是( )
| A. | ①②③ | B. | ①③④ | C. | ③④ | D. | ①②③④ |
17.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
| A. | 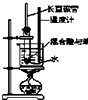 实验室制硝基苯 | B. |  石油分馏 | ||
| C. |  实验室用酒精制取乙烯 | D. | 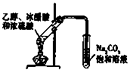 实验室制乙酸乙酯 |
4.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子最外层电子数:F>S>Ca |
1.下列有关实验的说法中正确的是( )
| A. | 制备硝基苯,混合药品的顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 | |
| B. | 银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热 | |
| C. | 在重结晶的实验中,使用长颈漏斗趁热过滤是为了减少被提纯物质的损失 | |
| D. | 苯甲酸的重结晶实验中要得到纯净的苯甲酸固体需要进行至少两次过滤操作 |
18.设计实验方案是科学探究的重要环节.以下化学实验设计中,能达到实验目的是( )
| A. | 用铜和稀硫酸反应制取硫酸铜溶液 | |
| B. | 用石灰石除去氯化钙溶液中混有的盐酸 | |
| C. | 用氢氧化钠溶液除去二氧化碳中混有的氯化氢气体 | |
| D. | 用酚酞试液检验暴露在空气中的NaOH固体是否变质 |