题目内容
8.某气态烃与氧气在120℃时,混合于密闭容器中,点燃充分燃烧后,恢复到原温度时压强不变,则该烃可能是( )①CH4 ②C2H4 ③C2H6 ④C3H4 ⑤C3H8 ⑥C3H6.
| A. | ③⑥ | B. | ②⑤ | C. | ①②③ | D. | ①②④ |
分析 燃烧前后容器内压强不变,说明燃烧前后气体的物质的量不变,则反应方程式中反应前后气体的化学计量数相等,据此结构烃的燃烧通式判断,注意120℃时水是气体.
解答 解:设烃的分子式为CxHy,燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,
温度保持在120℃,水为气体,若反应前后压强保持不变,则:
1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,
所以y=4,即满足烃分子中应含有4个H即可,①CH4 ②C2H4 ④C3H4 符合,
故选D.
点评 本题考查有机物燃烧反应方程式的计算,为高频考点,判断燃烧前后气体的物质的量不变是关键,注意从烃燃烧的方程式进行解答,侧重分析与计算能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | $\frac{4}{5}$v(NH3)=v(O2) | B. | $\frac{5}{6}$v(O2)=v(H2O) | C. | $\frac{3}{2}$v(NH3)=v(H2O) | D. | $\frac{5}{4}$v(O2)=v(NO) |
| A. | 向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明Ksp(AgCl)大于Ksp(AgI) | |
| B. | 盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 | |
| C. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,则可用CCl4从碘水中萃取碘单质 | |
| D. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- |
如果与溴水加成产物是2,2,3,3-四溴丁烷,则与W属同系物的是( )
| A. | 乙炔 | B. | 2-丁烯 | C. | 1,3-丁二烯 | D. | 异戊二烯 |
甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
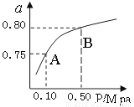
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(2)反应②是 (填“吸热”或“放热”)反应。
(3)判断反应③△H 0;△S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t 0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定温度下,C(s)和水蒸气在密闭容器中,建立平衡状态:C(s)+H2O(g) CO(g)+H2(g);ΔH>0。
CO(g)+H2(g);ΔH>0。
①平衡时混合气体的平均相对分子质量Mr(平)的取值范围为__________>Mr(平)>__________。
②若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气体的平均相对分子质量M′r(平)的取值范围为__________>M′r(平)>__________。
 CH3OH(g)
CH3OH(g)