��Ŀ����
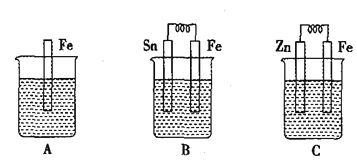
����Ŀ����ͼ��ijͬѧ��Ƶ���֤ԭ��غ͵��ص�ʵ��װ�ã������й�˵������ȷ����(����)
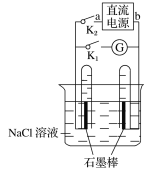
A. �ر�K2����K1���Թ��������������ݲ���
B. �ر�K2����K1��һ��ʱ���������Թ��ռ�����������Ҳ��Զ࣬��aΪ������bΪ����
C. �ر�K2����K1��һ��ʱ�����Ĵָ��ס�Թ��Ƴ��ձ������Թ��ڵ����̪����������Թ�����Һ���ɫ����aΪ������bΪ����
D. �ر�K2����K1��һ��ʱ����ٹر�K1����K2��������ָ�벻��ƫת
���𰸡�D
��������
A.�ر�K2����K1����װ��Ϊ���أ�NaCl��Һ����⣬����������������������������
B.����������ˮ�е��ܽ�ȱ�������һ��ʱ����Թ�������������Ϊ������
C.����������һ�������������ӣ���Һ�Լ��ԣ�������Һ��ʹ��̪��Һ��죻
D.һ��ʱ����ٹر�K1����K2ʱ��������������NaCl��Һ���γ�ԭ��ء�
A.�ر�K2����K1����װ��Ϊ���أ�NaCl��Һ����⣬�����ֱ������������������A��ȷ��
B.����������ˮ�е��ܽ�ȱ�������һ��ʱ�������������Ϊ�������õ缫Ϊ��������ü������ĵ�Դ�缫��Ϊ�����������������ĵ缫Ϊ��������ü������ĵ�Դ�缫��Ϊ��������B��ȷ��
C.����������һ��������ˮ����������ӣ��ٽ���ˮ�ĵ��룬��Һ�Լ��ԣ�������Һ��ʹ��̪��Һ��죬��C��ȷ��
D.һ��ʱ����ٹر�K1����K2ʱ��������������NaCl��Һ���γ�ԭ��أ��ŵ�ʱ�����������ָ�뷢��ƫ�ƣ���D����
��ѡD��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�����Ŀ��CO��H2��ú�����������������������;�㷺��
��1��CO��ԭ������������Ⱦ��SO2
��2CO��g�� + SO2��g�� ![]() S��s��+2CO2��g�� H = -270 kJ��mol��1���÷�Ӧ��ƽ�ⳣ������ʽΪ__��
S��s��+2CO2��g�� H = -270 kJ��mol��1���÷�Ӧ��ƽ�ⳣ������ʽΪ__��
���ھ��Ⱥ��ݵ��ܱ������н���������Ӧ������˵����ȷ����_____��
a ����������ܶȱ��ֲ��䣬���Ѵ�ƽ��״̬
b ��ƽ������ٳ���һ����CO2��ƽ�ⳣ�����ֲ���
c ���������S�������淴Ӧ���ʾ����ֲ��䣬ƽ�ⲻ�ƶ�
d �ӷ�Ӧ��ʼ��ƽ�⣬�����������ѹǿ���ֲ���
����2 L���º����ܱ�������ͨ��2 mol CO��1 mol SO2���ֱ����a��b��c����ʵ�顣�ڲ�ͬ�������·�����Ӧ��2CO��g�� + SO2��g�� ![]() S��s��+2CO2��g�� H = -270 kJ��mol��1����Ӧ��ϵ��ѹ��ʱ��ı仯���±���ʾ��������ʵ���¶ȵĴ�С��ϵ��_____����a��b��c��ʾ����ʵ��a�ӷ�Ӧ��ʼ��45s�ﵽƽ�⣬��ù��̷�Ӧ����v��SO2��__________���������2λ��Ч���֣���
S��s��+2CO2��g�� H = -270 kJ��mol��1����Ӧ��ϵ��ѹ��ʱ��ı仯���±���ʾ��������ʵ���¶ȵĴ�С��ϵ��_____����a��b��c��ʾ����ʵ��a�ӷ�Ӧ��ʼ��45s�ﵽƽ�⣬��ù��̷�Ӧ����v��SO2��__________���������2λ��Ч���֣���
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
��2������CO��H2���Ʊ���Ȼ������Ҫ��ӦΪ��
CO��g�� + 3H2��g�� ![]() CH4��g�� + H2O��g�� H1=-206.2 kJ��mol1��
CH4��g�� + H2O��g�� H1=-206.2 kJ��mol1��
CO��g�� + H2O��g�� ![]() CO2��g�� + H2��g�� H2 = -41.0 kJ��mol��1��
CO2��g�� + H2��g�� H2 = -41.0 kJ��mol��1��
H2O��l�� �TH2O��g�� H3 =+44 kJ��mol��1 ��
�ش��������⣺
�ٷ�ӦCO2��g�� + 4H2��g�� ![]() CH4��g�� + 2H2O��l�� ��H4 = ________ kJ��mol��1��ij�¶��£��ֱ�����ʼ�ݻ���ͬ�ĺ�ѹ����A����������B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ�ﵽƽ���ų������յ������϶����__�� ����A������B"����
CH4��g�� + 2H2O��l�� ��H4 = ________ kJ��mol��1��ij�¶��£��ֱ�����ʼ�ݻ���ͬ�ĺ�ѹ����A����������B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ�ﵽƽ���ų������յ������϶����__�� ����A������B"����
���ں�ѹ�ܵ���Ӧ���а�n��H2��:n��CO�� = 3:1ͨ��ԭ�������ڴ����������Ʊ��ϳ���Ȼ����400 �� p��Ϊ100 kPaʱ��Ӧ��ϵƽ��������±���ʾ��
��� | CH4 | H2O | H2 | CO2 | CO |
�������/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
���������CO����ת������=____��![]()
���Ʊ��ϳ���Ȼ��������ԭ������ͨ��ˮ���������������̼��
��̼��ӦΪ����ӦI ��CH4��g�� ![]() C��s�� + 2H2��g�� H = +75 kJ��mol��1��
C��s�� + 2H2��g�� H = +75 kJ��mol��1��
��Ӧ��2CO��g�� ![]() C��s�� + CO2��g�� H = -172 kJ��mol��1��
C��s�� + CO2��g�� H = -172 kJ��mol��1��
ƽ����ϵ��ˮ����Ũ�ȶԻ�̼����Ӱ����ͼ��ʾ������˵����ȷ����__��
A ����1��700 ~ 800���̼����С��ԭ������Ƿ�Ӧ�������ƶ�
B ����1��550 ~700���̼�������ԭ������Ƿ�ӦI�������������
C ����2��3��550 ~800���̼���ϵ͵�ԭ����ˮ����ϡ������ʹ��̼��Ӧ���ʼ�С
D ˮ���������շ�Ӧ�ų���������������ϵ�¶���550�����£������ڼ��ٻ�̼