题目内容
【题目】人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。
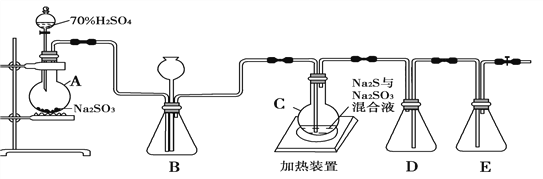
实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式___________________________________。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(3)装置E的作用是____________________。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_________________________。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________________________________。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式________________________________________。
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
部分反应的离子方程式为:① Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O
② I2+2S2O32-===S4O62-+2I-
滴定时Na2S2O3标准溶液应该用_____________________(填仪器名称)盛装,该废水中Ba2+的物质的量浓度为_______________________span>。
【答案】 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 调节硫酸的滴加速度 吸收多余的SO2或H2S,防止污染环境 2:1 取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH值 S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl- 碱式滴定管 0.0024 mol·L-1
【解析】(1)A中亚硫酸钠与硫酸反应生成二氧化硫和硫酸钠,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以通过调节硫酸的滴加速度实现,故答案为:调节硫酸的滴加速度;
(3)在装置C中,通入的二氧化硫使溶液呈现酸性,在酸性溶液中,存在Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq) 、2H2S(aq)+SO2(g) =3S(s)+2H2O(l)、S(s)+Na2SO3(aq) ![]() Na2S2O3(aq),二氧化硫和硫化氢会污染环境,因此装置E可以吸收多余的SO2或H2S,防止污染环境,故答案为:吸收多余的SO2或H2S,防止污染环境;
Na2S2O3(aq),二氧化硫和硫化氢会污染环境,因此装置E可以吸收多余的SO2或H2S,防止污染环境,故答案为:吸收多余的SO2或H2S,防止污染环境;
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,根据2H2S(aq)+SO2(g) =3S(s)+2H2O(l),烧瓶C中Na2S和Na2SO3物质的量之比为2:1,故答案为:2:1;
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定的具体操作为取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH值,故答案为:取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH值;
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,氯气被还原为氯离子,反应的离子化学方程式为S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-,故答案为:S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-;
(7)Na2S2O3溶液水解,溶液显碱性,应该选用碱式滴定管盛放Na2S2O3溶液进行滴定;根据表中数据可知,数据2有较大偏差,应舍去,消耗Na2S2O3标准溶液的体积为数据1、2、3的平均值,体积为![]() mL=18.00mL,根据反应①Cr2O72-+61-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-===S4O62-+2I-,可得关系式6n(S2O32-)~n(Cr2O72-)~2n(Ba2+),滴定用去的Na2S2O3的物质的量为0.010 mol/L×0.018L=1.8×10-4mol,所以Ba2+的物质的量为
mL=18.00mL,根据反应①Cr2O72-+61-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-===S4O62-+2I-,可得关系式6n(S2O32-)~n(Cr2O72-)~2n(Ba2+),滴定用去的Na2S2O3的物质的量为0.010 mol/L×0.018L=1.8×10-4mol,所以Ba2+的物质的量为![]() ×1.8×10-4mol=6×10-5mol,25.00mL废水中Ba2+的物质的量浓度为
×1.8×10-4mol=6×10-5mol,25.00mL废水中Ba2+的物质的量浓度为![]() mol/L=0.0024 mol/L ,故答案为:碱式滴定管;0.0024 mol/L。
mol/L=0.0024 mol/L ,故答案为:碱式滴定管;0.0024 mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D