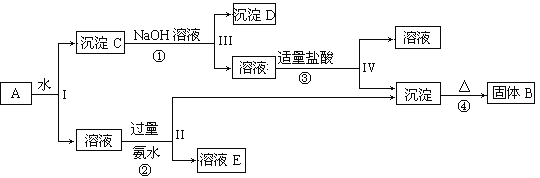
题目内容
【题目】为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空:
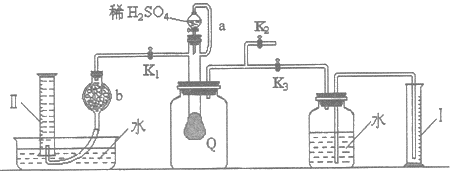
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。
(2)导管a的作用是________。
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。
(5)b中装的固体试剂是________。
【答案】2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑ 平衡分液漏斗上下的压强使顺利流下 K1、K2 K3 气球Q慢慢缩小,量筒Ⅱ内液面下降 碱石灰(或生石灰,或氢氧化钠)
【解析】
根据常见化学实验基础操作及注意事项分析;根据过氧化钠的化学性质分析;
(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,这两个反应的离子方程式为2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑;
(2)为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下;
(3)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3;
(4)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小,量筒Ⅱ内液面下降;
(5)想要收集到纯净O2需要把混合气体中的CO2除去,故混合气体通过b碱石灰(或生石灰,或氢氧化钠)吸收CO2。

【题目】人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。

实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式___________________________________。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(3)装置E的作用是____________________。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_________________________。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________________________________。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式________________________________________。
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
部分反应的离子方程式为:① Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O
② I2+2S2O32-===S4O62-+2I-
滴定时Na2S2O3标准溶液应该用_____________________(填仪器名称)盛装,该废水中Ba2+的物质的量浓度为_______________________span>。