题目内容
【题目】(1)、按要求填空:
①、第三周期中有两个成单电子的元素符号是__________。
②、四核10电子的粒子的电子式(写一种)__________。
③、第四周期中,3d轨道半充满的元素符号是__________。
(2)、写出符合下列条件的元素原子的电子排布式:
①、自然界中含量居第二的金属元素__________。
②、第四周期0族元素__________。
③、能形成自然界中最硬的单质的元素__________。
【答案】 Si、S 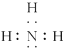 Cr、Mn 1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p6 1s22s22p2
Cr、Mn 1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p6 1s22s22p2
【解析】
(1)①第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4;②四核10电子粒子中含4个原子、电子数为10;③第四周期元素中,4p轨道半充满说明4p轨道中含有3个电子,3d轨道半充满说明3d轨道中含有5个电子;(2)处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写,以此解答该题。
(1)①第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4,所以为Si、S;②四核10电子粒子中含4个原子、电子数为10,符合条件的有NH3、H3O+,氨气的电子式为: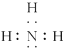 ;③3d轨道半充满说明3d轨道中含有5个电子,根据电子排布规则知,该原子的4s能级上电子全满或半充满,所以该基态原子的核外电子排布式为:[Ar]3d54s1或[Ar]3d54s2,所以为Cr和Mn;(2)①自然界中含量居第二的金属元素为铁,电子排布式为1s22s22p63s23p63d64s2;②第四周期0族元素为Kr,电子排布式为1s22s22p63s23p63d104s24p6;③能形成自然界中最硬的单质的元素为碳,电子排布式为1s22s22p2。
;③3d轨道半充满说明3d轨道中含有5个电子,根据电子排布规则知,该原子的4s能级上电子全满或半充满,所以该基态原子的核外电子排布式为:[Ar]3d54s1或[Ar]3d54s2,所以为Cr和Mn;(2)①自然界中含量居第二的金属元素为铁,电子排布式为1s22s22p63s23p63d64s2;②第四周期0族元素为Kr,电子排布式为1s22s22p63s23p63d104s24p6;③能形成自然界中最硬的单质的元素为碳,电子排布式为1s22s22p2。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案