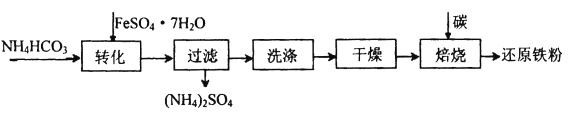
题目内容
【题目】铜及其化合物有着十分重要的用途:如氨基乙酸铜[结构简式为(H2NCH2COO)2Cu]常用作食品补铜剂及矿物元素饲料添加剂,硒化铜纳米晶在光电转化中有着广泛地应用;硫酸铜可用作配制农药等。
(1)基态硒原子的电子排布式为____,基态氮原子电子的空间运动状态有__种,与硒同周期相邻的三种元素第一电离能由大到小的顺序为______
(2)(H2NCH2COO)2Cu氨基乙酸铜中,碳原子的杂化轨道类型是______;与氮原子成键的原子(含氮原子本身)形成的空间构型是__________。
(3)硫酸铜晶体的组成可表示为[Cu(H2O)4]SO4·H2O,实验测得该物质中存在氢键且水分子成“键”情况与冰中类似,则1mol[Cu(H2O)4]SO4·H2O中氢键数目为__NA。
(4)硫酸铜在高温下分解有可能得到CuO、Cu2O、SO2、SO3等物质,其中CuO的熔点为1026℃。
①CuO的晶体类型是_____,熔点Cu2O>Cu2S的原因是______
②SO2与SO3中,属于非极性分子的是__,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是___________
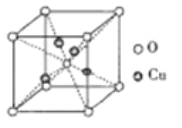
③铜的某种氧化物的晶胞如下图所示,则该氧化物的化学式为_______,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度ρg/cm3,阿伏加德罗常数值为NA,则该晶胞的空间利用率为______(用含π的式子表示)。
【答案】 [Ar]3d104s24p4 5 Br>As>Se sp2、sp3 三角锥 2 离子晶体 离子半径O2-<S2-,Cu2O晶格能比CuS的大 SO3 H2O Cu2O ![]() 10-30
10-30
【解析】试题分析:本题考查原子核外电子排布式的书写、第一电离能大小的比较、杂化方式和空间构型的判断、氢键的计算、晶体类型的判断、晶体熔点的比较、物质的溶解性、晶胞的分析和计算。
(1)硒的原子序数为34,Se原子核外有34个电子,根据构造原理,基态硒原子的电子排布式为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4。基态N原子的核外电子排布式为1s22s22p3,电子排布图为![]() ,一个原子轨道就是一种空间运动状态,基态N原子电子的空间运动状态有5种。与Se同周期的相邻的三种元素为As、Se、Br,根据同周期从左到右元素的第一电离能呈增大趋势,As的价电子排布式为4s24p3,As的4p处于半充满较稳定,第一电离能As
,一个原子轨道就是一种空间运动状态,基态N原子电子的空间运动状态有5种。与Se同周期的相邻的三种元素为As、Se、Br,根据同周期从左到右元素的第一电离能呈增大趋势,As的价电子排布式为4s24p3,As的4p处于半充满较稳定,第一电离能As![]() Se,则三种元素的第一电离能由大到小的顺序为:Br
Se,则三种元素的第一电离能由大到小的顺序为:Br![]() As
As![]() Se。
Se。
(2)氨基乙酸铜中,连接2个H的碳原子为饱和碳原子,该碳原子形成2个碳氢σ键、1个碳碳σ键和1个碳氮σ键,该碳原子为sp3杂化;与氧原子连接的碳原子形成1个碳氧双键(含1个σ键和1个π键)、1个碳氧单键(σ键)和1个碳碳单键(σ键),该碳原子为sp2杂化。N原子形成2个氮氢σ键和1个碳氮σ键,N原子上有1对孤电子对,N原子为sp3杂化,与N原子成键的原子(含氮原子本身)形成的空间构型为三角锥形。
(3)硫酸铜晶体中存在氢键且水分子成“键”情况与冰中类似,1mol冰晶体中存在2mol氢键,则1mol[Cu(H2O)4]SO4·H2O中存在2mol氢键,含氢键数目为2NA。
(4)①CuO的熔点较高,CuO属于离子晶体。熔点Cu2O![]() Cu2S的原因是:O2-的离子半径小于S2-,Cu2O的晶格能大于Cu2S。
Cu2S的原因是:O2-的离子半径小于S2-,Cu2O的晶格能大于Cu2S。
②SO2的空间构型为V形,SO2为极性分子;SO3的空间构型为平面正三角形,SO3为非极性分子;SO2与SO3中属于非极性分子的是SO3。SO2、H2O都属于极性分子,CCl4属于非极性分子,根据“相似相溶”经验规律,相同温度下,能溶解更多SO2的溶剂是H2O。
③用“均摊法”,晶胞中含Cu:4个,O:8![]() +1=2个,Cu与O的个数比为2:1,该氧化物的化学式为Cu2O。1个晶胞中氧、铜的体积之和为(4
+1=2个,Cu与O的个数比为2:1,该氧化物的化学式为Cu2O。1个晶胞中氧、铜的体积之和为(4![]() πrCu3+2
πrCu3+2![]() πrO3)
πrO3)![]() 10-30cm3;1mol晶体的体积为
10-30cm3;1mol晶体的体积为![]() =
=![]() cm3,1个晶胞的体积为
cm3,1个晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 2=
2=![]() cm3,该晶胞的空间利用率为(4
cm3,该晶胞的空间利用率为(4![]() πrCu3+2
πrCu3+2![]() πrO3)
πrO3)![]() 10-30cm3
10-30cm3![]() cm3=
cm3=![]() 10-30。
10-30。