题目内容
【题目】铁及其化合物在日常生活中有广泛应用。
(1)写出铁元索在周期表中的位置__________。
(2)写出在空气中Fe(OH)2转化为Fe(OH)3的化学方程式____________。
(3)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。
①由FeSO4溶液制得FeSO4·7H2O过程中的操作有______、过滤、洗涤、干燥。
②检验绿矾是否变质的试剂是________。
(4)利用绿矾制备还原铁粉的工业流程如下:
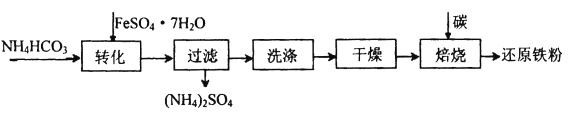
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为_______________。
②取干燥后的FeCO3样品12.49g,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量___________。
(5)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
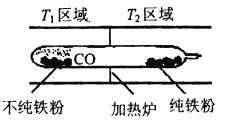
Fe(s)+5CO(g)![]() Fe(CO)5(g) △H<0,T1___T2(填“>”、“<”或“=”)。
Fe(CO)5(g) △H<0,T1___T2(填“>”、“<”或“=”)。
【答案】 第四周期第Ⅷ族 4Fe(OH)2+O2+2H2O==4Fe(OH)3 蒸发浓缩、冷却结晶 KSCN溶液 4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O 0.89g <
【解析】(1)铁的核电荷数为26,核外电子排布为1s22s22p63s23p63d64s2,位于周期表中第四周期第Ⅷ族;正确答案:第四周期第Ⅷ族。
(2)Fe(OH)2与空气中的氧气、水共同反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;正确答案:4Fe(OH)2+O2+2H2O==4Fe(OH)3 。
(3)①由FeSO4溶液先进行加热浓缩,变为浓溶液,然后冷却结晶、过滤、洗涤、干燥等操作,制得FeSO4·7H2O;正确答案:蒸发浓缩、冷却结晶。
②亚铁离子还原性较强,易被氧化为铁离子;因此检验绿矾是否变质,就是要检验铁离子的存在,可以用硫氰化钾溶液,若出现红色溶液,则有铁离子存在,绿矾(FeSO4·7H2O)已变质;正确答案:KSCN溶液。
(4)①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,根据氧化还原反应的电子守恒和原子守恒规律,化学方程式为: 4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O ;正确答案:4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O 。
②设样品中FeCO3的物质的量为xmol, FeOOH的物质的量为ymol,则根据质量守恒和铁原子的量守恒列方程如下:116x+89y=12.49,x+y=6.16/56=0.11,解之得y=0.01mol,样品中杂质FeOOH的质量为0.01×89=0.89g,正确答案:0.89g。
(5)反应Fe(s)+5CO(g)![]() Fe(CO)5,△H<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,所以T1<T2;正确答案:<。
Fe(CO)5,△H<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,所以T1<T2;正确答案:<。

 习题精选系列答案
习题精选系列答案