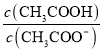题目内容
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
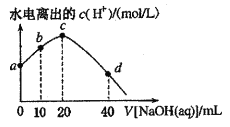
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
【答案】B
【解析】
A.a点溶液没有加入NaOH,为醋酸溶液,根据电离平衡常数计算。设电离的出的H+的浓度为x,由于电离程度很低,可认为醋酸浓度不变。
CH3COOH![]() CH3COO-+H+
CH3COO-+H+
2 x x
Ka=![]() =
=![]() =1.8×10-5,解得x=6.0×10-3mol/L,A项正确;
=1.8×10-5,解得x=6.0×10-3mol/L,A项正确;
B.b点的溶液为CH3COOH和CH3COONa等浓度混合的溶液,物料守恒为c(CH3COOH) +c(CH3COO-)=2c(Na+),醋酸会电离CH3COOH![]() CH3COO-+H+,醋酸根会水解,CH3COO-+H2O
CH3COO-+H+,醋酸根会水解,CH3COO-+H2O![]() CH3COOH+OH-,水解平衡常数
CH3COOH+OH-,水解平衡常数![]() <1.8×10-5,CH3COOH的电离大于CH3COO-的水解,所以c(CH3COO-)> c(Na+)> c(CH3COOH);B项错误;
<1.8×10-5,CH3COOH的电离大于CH3COO-的水解,所以c(CH3COO-)> c(Na+)> c(CH3COOH);B项错误;
C.c点醋酸和氢氧化钠完全反应,溶液为CH3COONa溶液,在醋酸钠溶液中有电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),有物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),将两式联立得到质子守恒,则有c(OH-)=c(CH3COOH)+ c(H+);C项正确;
D.d点加入40mL的NaOH溶液,NaOH多一倍,为等物质的量浓度的NaOH和CH3COONa的混合溶液,有物料守恒c(Na+)=2c(CH3COO-)+2c(CH3COOH),D项正确;
本题答案选B。

 浙江名校名师金卷系列答案
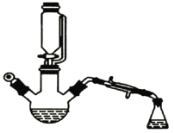
浙江名校名师金卷系列答案【题目】用下图所示装置制备乙酸乙酯粗产品(加热和夹持装置等省略),有关数据如下表所示:
物质 | C2H5OH | CH3COOH | CH3COOC2H5 |
密度g/cm3 | 0.79 | 1.05 | 0.90 |
沸点/℃ | 78.3 | 118 | 77.1 |
已知:乙醇可以和氯化钙反应生成微溶于水的CaC12·6C2H5OH。在三颈烧瓶内将过量的乙醇和少量的浓硫酸混合,然后经恒压分液斗边滴加酸,边加热蒸馏。得到含有乙醇、醋酸和水的乙酸乙酯粗产品。
(1)混合乙醇与浓硫酸时,应先加入的试剂是_______;浓硫酸的作用是__________。
(2)边滴加醋酸,边加热蒸馏的目的是_______。将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向粗产品中加入______(填序号)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)向其中加入饱和氯化钙溶液。振荡、分离。其目的是______。
(5)然后再向其中加入无水硫酸钠,振荡,静置,以除去水分。最后,将经过上述处理后的液体放入一干燥的蒸馏烧瓶内。再蒸馏,弃去低沸点馏分,收集沸程76℃~____℃(填“78”或“118“)之间的馏分即得纯净的乙酸乙酯。
(6)在实验中原料用量:23.0mL乙醇、15.0mL冰醋酸,最终得到16.0mL乙酸乙酯,则本次实验中乙酸乙酯的产率为________(百分数精确到0.1)。
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4gCaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5mL溶液a置于试管中,滴入两滴石蕊溶液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_____________。
②加入石蕊溶液后溶液褪色可能是因为溶液a中存在较多的_____________。
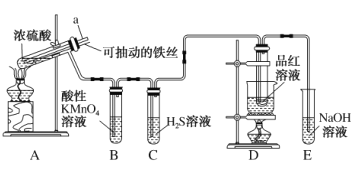
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
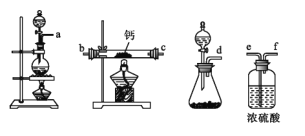
①请选择实验所需要的装置,按气流方向连接的顺序为_____________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_____________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO28H2O↓+2![]() 在碱性环境下制取CaO2的装置如图所示。
在碱性环境下制取CaO2的装置如图所示。
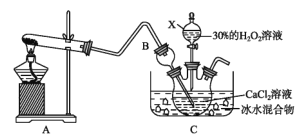
①NH3在Ca2+和H2O2的反应过程中所起的作用是_____________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO28H2O。过滤需要的玻璃仪器是_____________;将沉淀进行洗涤的操作为_____________。