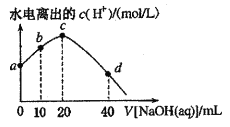
题目内容
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
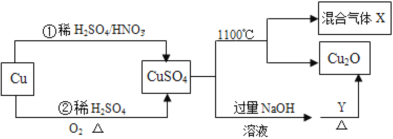
A.Y一定是葡萄糖溶液
B.相对于途径①,途径②更好地体现了绿色化学理念
C.混合气体X是只有SO2和SO3组成的混合气体
D.将CuSO4溶液蒸发浓缩、冷却结晶可制得硫酸铜晶体
【答案】AC
【解析】
A.葡萄糖含有醛基,醛基能被氢氧化铜氧化生成Cu2O,所以Y可能为葡萄糖,也可以为其它含有醛基的物质,故A错误;
B.相对于途径①,铜和浓硫酸反应会生成二氧化硫气体污染空气,途径②的优点:制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,更好地体现了绿色化学思想,故B正确;
C.硫酸铜分解生成Cu2O与氧气、SO3、SO2,根据2CuSO4=Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、氧元素化合价只有降低,无元素化合价升高,故C错误;
D.将CuSO4溶液蒸发浓缩、冷却结晶,过滤洗涤可制得胆矾晶体,故D正确;
答案选AC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目