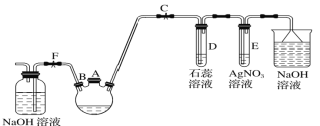
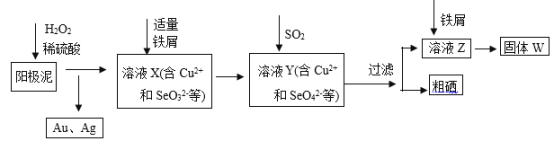
题目内容
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
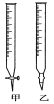
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
【答案】甲 当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点 2 偏大 偏小
【解析】
(1)因为酸性高锰酸钾溶液具有强氧化性,结合滴定管的适用要求作答;
(2)根据KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)由题给化学方程式及数据计算出1.260g纯草酸晶体中含H2C2O4的物质的量,然后求出1.260g纯草酸晶体中含H2O的物质的量,根据H2O的物质的量和纯草酸晶体的物质的量的关系求出x;根据操作不当对标准液消耗的体积变化来判断H2C2O4的物质的量的误差,进而推出纯草酸晶体中含H2O的物质的量误差变化。
(1)酸性高锰酸钾溶液具有强氧化性,腐蚀橡皮管,所以用需用酸式滴定管,甲正确,
故答案为:甲;
(2)当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)2MnO4+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
2 5
0.1000mol/L×0.01L 0.0025mol
25.00 mL待测液中含有0.0025 mol H2C2O4,100.00 mL待测液中含有0.01mol H2C2O4,其质量为0.01 mol×90 g/mol=0.9 g,所以1.260 g纯草酸晶体中水的物质的量为1.260 g0.9 g=0.36 g,其物质的量为0.02 mol,则x=2;
①若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x值偏大;
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则消耗的标准液的体积偏大,最终导致n(H2C2O4)偏大,则n(H2O)偏小,x值偏小;
故答案为:2;偏大;偏小。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关实验操作、现象和目的或结论的说法正确的是( )
选项 | 操作 | 目的或结论 |
A | 将Fe(NO3)2晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变化 | 检验Fe(NO3)2样品是否已被氧化而变质 |
B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物1-2min | 主要目的是去除溶液中的氧气,避免氧气氧化碘离子 |
C | 在试管中依次加入2mL浓硫酸、3mL乙醇和2mL乙酸,用酒精灯缓慢加热 | 制备乙酸乙酯 |
D | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分震荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
A.AB.BC.CD.D