题目内容
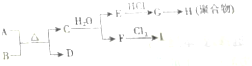
5.通过粮食发酵可获得某含氧有机化合物A,A蒸汽的密度是相同条件H2密度的23倍,2.3g A完全燃烧生成2.24L CO2(标准状况)和2.7g H2O.求A的分子式(写出计算过程)分析 相对密度与相对分子质量成正比,据此可计算出A的相对分子质量;然后根据n=$\frac{V}{{V}_{m}}$、n=$\frac{m}{M}$分别计算出标况下2.24L二氧化碳、2.3gA、2.7g水的物质的量,再根据质量守恒定律计算出A的分子式.
解答 解:A蒸汽的密度是相同条件H2密度的23倍,则A的相对分子质量为:2×23=46,
2.3gA的物质的量为:$\frac{2.3g}{46g/mol}$=0.05mol,
标况下2.24L二氧化碳的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
2.7g水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,含有0.3molH,
根据质量守恒,0.05molA中含有0.1molC、0.3molH,则A分子中含有C、H原子数为:N(C)=$\frac{0.1mol}{0.05mol}$=2、N(H)=$\frac{0.3mol}{0.05mol}$=6,
A中含有氧原子的数目为:N(O)=$\frac{46-12×2-1×6}{16}$=1,
则有机物A的分子式为:C2H6O,
答:有机物A的分子式为:C2H6O.
点评 本题考查了有机物分子式的确定,题目难度中等,明确相对密度与摩尔质量的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.

练习册系列答案
相关题目
15.化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | 开发核能、太阳能等新能,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 | |
| D. | 汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 |
16.下列说法正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | NO可用于某些疾病的治疗 | |
| C. | NO2通入FeSO4溶液中始终无明显现象 | |
| D. | 汽车尾气的主要污染成分包括NO、CO和N2 |
13.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 常温常压下环癸五烯 是一种易溶于水的无色气体 是一种易溶于水的无色气体 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
2.下列关于σ键和π键的理解不正确的是( )
| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | HBr 分子中的σ键是s-p σ键,Cl2分子中的σ键是p-p σ键 | |
| D. | 气体单质中一定存在σ键,可能存在π键 |
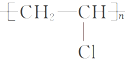 ;
; ,分子的立体构型是平面三角形.
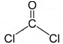
,分子的立体构型是平面三角形.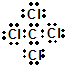 ,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).
,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).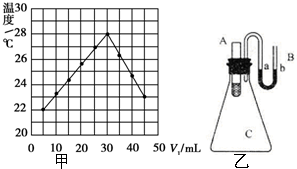 实验题:将V1 mL 1.0mol•L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空:
实验题:将V1 mL 1.0mol•L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空: