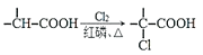
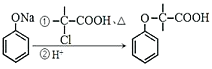
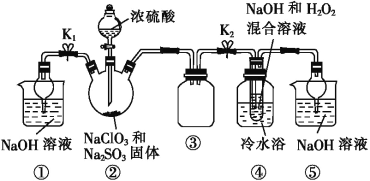
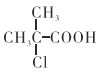题目内容
【题目】短周期元素A、B、C的原子序数逐渐增大,它们形成的离子具有相同的电子层结构,B和C的单质都能跟水剧烈反应,1 mol B单质跟水反应时,在标准状况下放出11.2 L A的气态单质,0.5 mol C单质跟水反应时,在标准状况下放出5.6 L H2,此时C转化成具有氖原子核外电子层结构的离子。问:
(1)写出A、B、C各元素的名称_____________。
(2)用电子式表示AC形成的一种淡黄色化合物_____________。
(3)用电子式表示BC形成化合物的过程_____________。
(4)用电子式表示A的简单氢化物的形成过程_____________。并解释沸点反常高的原因_____________。
【答案】氧、氟、钠 ![]()
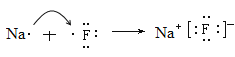
![]() 分子间存在氢键
分子间存在氢键
【解析】
短周期元素A、B、C的原子序数逐渐增大,它们形成的离子具有相同的电子层结构,B和C的单质都能跟水剧烈反应,0.5 mol C单质跟水反应时,在标准状况下放出5.6 L H2,氢气是0.25mol,转移0.5mol电子,这说明C在反应中失去1个电子,由于此时C转化成具有氖原子核外电子层结构的离子,则C是Na。1 mol B单质跟水反应时,在标准状况下放出11.2 L A的气态单质,气体的物质的量是0.5mol,因此A是O,B是F。据此解答。
根据以上分析可知A、B、C分别是O、F、Na。则
(1)A、B、C各元素的名称分别是氧、氟、钠。
(2)AC形成的一种淡黄色化合物是过氧化钠,含有离子键,则用电子式表示AC形成过程可表示为![]() 。
。
(3)BC形成化合物是离子化合物NaF,则用电子式表示BC形成化合物的过程为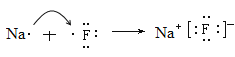 。
。
(4)A的简单氢化物是水,则用电子式表示A的简单氢化物的形成过程为![]() 。由于水分子间存在氢键,因此其沸点反常高。
。由于水分子间存在氢键,因此其沸点反常高。