题目内容
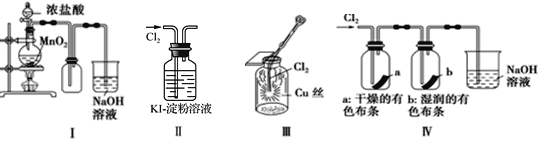
【题目】如图是一套制取并验证氯气部分化学性质的实验装置。
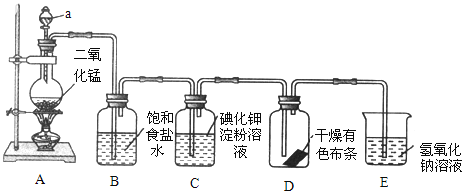
回答下列问题:
(1)装置 A 中,仪器 a 的名称叫_____,该仪器中盛放的试剂为_____,装置 B的作用是_____。
(2)装置 A 中发生反应的化学方程式是_____。
(3)当 Cl2 持续通过时,装置 D 中干燥的有色布条能否褪色?为什么?_____,____。
(4)若要证明干燥的 Cl2 无漂白性,可在装置 D 前添加一个装有_____的洗气瓶。
(5)装置 E 的作用是_____,该反应的离子方程式为_____。
【答案】分液漏斗 浓盐酸 吸收 HCl MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2 ↑ 能褪色 因为 Cl2 与带出的 H2O(g)反应生成 HClO,使有色布条褪色 浓 H2SO4 除去多余的 Cl2 Cl2+2OH=Cl+ClO+H2O
MnCl2 + 2H2O + Cl2 ↑ 能褪色 因为 Cl2 与带出的 H2O(g)反应生成 HClO,使有色布条褪色 浓 H2SO4 除去多余的 Cl2 Cl2+2OH=Cl+ClO+H2O
【解析】
本题实验目的是制取Cl2和验证Cl2部分化学性质,从装置图上看,A装置是实验室制Cl2的“固+液![]() 气”装置,分液漏斗a中盛装浓盐酸,产生的Cl2中混合HCl气体, Cl2难溶于食盐水,而HCl极易溶于水,所以饱和食盐水的作用就是除去Cl2中的HCl气体,;Cl2能置换I2,淀粉溶液遇I2变蓝;Cl2有毒,必须有尾气吸收装置,E中NaOH溶液能很好地吸收Cl2:2NaOH+Cl2=NaCl+NaClO+H2O,由此分析解答。
气”装置,分液漏斗a中盛装浓盐酸,产生的Cl2中混合HCl气体, Cl2难溶于食盐水,而HCl极易溶于水,所以饱和食盐水的作用就是除去Cl2中的HCl气体,;Cl2能置换I2,淀粉溶液遇I2变蓝;Cl2有毒,必须有尾气吸收装置,E中NaOH溶液能很好地吸收Cl2:2NaOH+Cl2=NaCl+NaClO+H2O,由此分析解答。
(1)仪器a的名称叫分液漏斗,该仪器中盛放浓盐酸,为实验中添加浓盐酸,控制反应速率。因Cl2在饱和食盐水中溶解度很小,而HCl气体极易溶液于水,所以装置B吸收HCl,以除去Cl2的混有的HCl气体。
(2)浓盐酸与MnO2在加热条件下反应制取Cl2,其化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)当Cl2通过B、C溶液时会带有水蒸气,D中干燥的有色布条遇到潮湿的Cl2时有反应Cl2+H2O=HCl+HClO,HClO具有漂白性,所以有色布条褪色。
(4)若要证明干燥的Cl2无漂白性,就必须将Cl2中的水蒸气除去,而题目要求是通过洗气瓶,因此应选用液态干燥剂浓硫酸,所以在装置 D 前添加一个装有浓硫酸的洗气瓶。
(5)Cl2有毒,不能排放到大气中,多余的Cl2必须吸收,因Cl2易与NaOH溶液反应:2NaOH+Cl2=NaCl+NaClO+H2O,所以装置E的作用是除去多余的Cl2;该反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O。