题目内容
9.有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3.电池的总反应式为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2.该电池放电时,下列说法中正确的( )| A. | 正极反应为2CO2+O2+4e-═2CO32- | |
| B. | CO32-向正极移动 | |
| C. | 电子由正极经外电路流向负极 | |
| D. | 电池中CO32-的物质的量将逐渐减少 |
分析 A.正极上氧气得电子和二氧化碳反应生成碳酸根离子;
B.放电时,阴离子向负极移动;
C.放电时,电子从负极沿导线流向正极;
D.根据电池反应式知,碳酸根不参加反应.
解答 解:A.正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为2CO2+O2+4e-═2CO32-,故A正确;
B.放电时,阴离子向负极移动,所以CO32-向负极移动,故B错误;
C.放电时,负极上失电子、正极上得电子,电子从负极沿导线流向正极,故C错误;
D.根据电池反应式知,碳酸根不参加反应,则电池中CO32-的物质的量,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确正负极的判断、电极反应式的书写、离子及电子移动方向等知识点即可解答,难点是电极反应式的书写,燃料电池中电解质有酸性溶液、碱性溶液、熔融盐、熔融氧化物等几种类型,注意结合电解质书写电极反应式.

练习册系列答案
相关题目
20.化学与生活息息相关.下列说法正确的是( )
| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
17.某个有机化合物分子式为C4H8O2,其PMR谱中有4个信号且强度之比为3:2:2:1,该有机化合物的结构简式可写( )
| A. | 2种 | B. | 3种 | C. | 5种 | D. | 6种 |
4.下列叙述正确的是( )
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. | 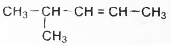 命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |
14.关于下列各实验装置图的叙述中,不正确的是( )
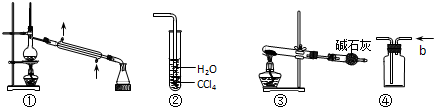

| A. | 装置①常用于分离某些互溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气,可用排空气法收集H2、NO等气体 |
3.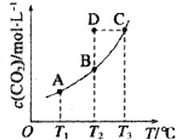 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 | |
| B. | 在T2时,若反应处于状态D,则一定有υ正>υ逆 | |
| C. | 平衡状态A 与C 相-比,平衡状态A 的c(CO)大 | |
| D. | 若T1、T2 时的平衡常数分别为K1、K2则K1>K2 |
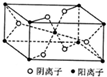 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子. .
.