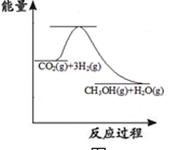
题目内容
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为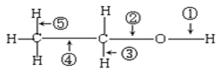
| A.和乙酸共热时,断裂①键 |
| B.和金属钠反应时,键①断裂 |
| C.和P2O5共热时,键②⑤断裂 |
| D.在铜催化下和氧气反应时,键①⑤断裂 |
D
解析试题分析:乙醇和乙酸共热发生酯化反应,生成乙酸乙酯,其中乙醇提供氢原子,则断键位置是①,乙醇选项A正确;乙醇与与金属钠反应生成乙醇钠和氢气,键①断裂,所以B正确;乙醇和P2O5共热时,发生消去反应生成乙烯,则键②⑤断裂,选项C正确;在铜催化下和氧气反应时,生成乙醛,键①③断裂,选项D不正确,答案选D。
考点:考查乙醇的化学性质
点评:该题是基础性试题的考查,难度不大。主要是考查学生对乙醇结构和性质的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力。掌握有机化学反应中断键的位置是解答的关键。

练习册系列答案
相关题目
某化学反应的能量变化如图所示。下列有关叙述正确的是( )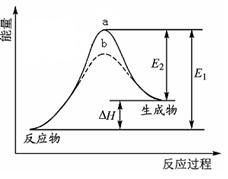
| A.该反应的反应热△H=E2-E1 |
| B.a、b分别对应有催化剂和无催化剂的能量变化 |
| C.催化剂能降低反应的活化能 |
| D.催化剂能改变反应的焓变 |
既是氧化还原反应,又是吸热反应的是
| A.氢气在氧气中燃烧 | B.铝片与稀硫酸反应 |
| C.灼热的炭与水蒸气反应 | D.消石灰与氯化铵固体反应 |
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)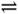 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
下列热化学方程式中,ΔH的绝对值能表示可燃物的燃烧热的是( )
A.C(s)+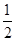 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 |
| B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
D.CO(g)+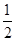 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 |
(7分)某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
| 装置(气密性良好,试剂已添加) | 操作 | 现象 |
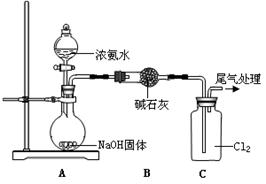 | 打开分液漏斗活塞,逐滴加入浓氨水 | ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |
(1)浓氨水分解可以制氨气,写出A中反应的化学方程式是 。从平衡移动 的角度分析NaOH固体在氨水分解中的作用 。
(2)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)= N2(g)+6HCl(g) ?H=—456 kJ·mol-1
已知:
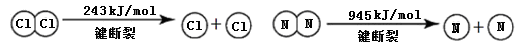
①NH3的电子式是 。
②断开1mol H-N键与断开1molH-Cl键所需能量相差约为 ,
(3)现象ⅱ中产生白烟的化学方程式是 。
(4)为避免生成白烟,该学生设计了下图装置以完成Cl2和NH3的反应。
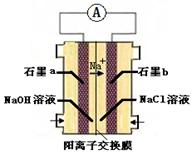
若该装置能实现设计目标,则①石墨b电极上发生的是 反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式: 。
根据下图可以写出热化学方程式As2O5(s) = As2O3( s) +O2( g) △H =" a" kJ/mol。则a为
| A.+1533.8 | B.— 1533.8 | C.+295.4 | D.—295.4 |
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)