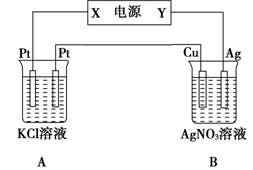
题目内容
既是氧化还原反应,又是吸热反应的是
| A.氢气在氧气中燃烧 | B.铝片与稀硫酸反应 |
| C.灼热的炭与水蒸气反应 | D.消石灰与氯化铵固体反应 |
C
解析试题分析:凡是有元素化合价升降的反应都是氧化还原反应。A、B都是放热的氧化还原反应;D是吸热反应,但不属于氧化还原反应。C是吸热的氧化还原反应,答案选C。
考点:考查氧化还原反应、放热反应以及吸热反应的判断
点评:该题是基础性试题的考查,难度不大。该题的关键是明确氧化还原反应的判断依据,其次还需要记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
臭氧层是地球上生物的保护层,在平流层存在:2O3 3O2 ;O3
3O2 ;O3 O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3
O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3 3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是
3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是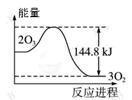
| A.氟利昂释放出的氯原子是臭氧层中促进O3分解的催化剂 |
| B.高压放电条件下O2可以转化成O3 |
| C.O3转变为O2时的能量变化可用右图表示 |
D.t ℃时3O2 2O3 K≈3.33×10-77 2O3 K≈3.33×10-77 |
下列说法正确的是:( )
A.在100 ℃.101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 |
| B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)= 6.82 × 10-6 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
| D.已知: |
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应
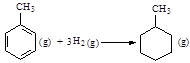 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1 下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
| A.Na和O2 | B.NaOH和CO2 |
| C.Na2O2和CO2 | D.AlCl3和NaOH |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: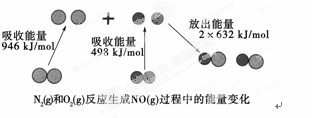
下列说法中正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在O2中的燃烧反应 |
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为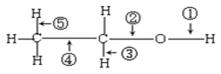
| A.和乙酸共热时,断裂①键 |
| B.和金属钠反应时,键①断裂 |
| C.和P2O5共热时,键②⑤断裂 |
| D.在铜催化下和氧气反应时,键①⑤断裂 |
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1则反应 CO(g)+H2O(g)
 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=______ _____;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。