题目内容
【题目】25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,下列判断不正确的是( )
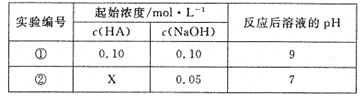
A.X>0.05
B.将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大
C.实验①所得溶液c(A-)+c(HA)=0.10mol·L-1
D.实验②所得溶液: c(Na+)+c(OH-)= c(A-)+c(H+)
【答案】C
【解析】
根据表中实验①数据分析,等浓度等体积的HA与氢氧化钠溶液混合后恰好反应生成盐,溶液显碱性,说明为弱酸,反应生成了强碱弱酸盐;据以上分析解答。
根据表中实验①数据分析,等浓度等体积的HA与氢氧化钠溶液混合后恰好反应生成盐,溶液显碱性,说明为弱酸,反应生成了强碱弱酸盐;
A、HA为弱酸,当X=0.05时,反应后恰好完全反应生成盐,溶液显碱性,若要使溶液显中性,则加入的酸稍微过量,则X>0.05,正确,不选A;
B、将实验①所得溶液加水稀释后,溶液中酸根离子水解程度增大,则溶液中氢氧根离子的物质的量大,酸根离子的物质的量减小,由于在同一溶液中,则![]() 变大,正确,不选B;
变大,正确,不选B;
C、混合溶液中存在物料守恒,根据物料守恒分析(二溶液等体积混合),所以c(A-)+c(HA)= c(Na+)=0.05mol·L-1,错误,选C;
D、根据混合溶液中电荷守恒,c(Na+)+c(OH-)= c(A-)+c(H+),正确,不选D;
故答案选C。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】已知M(g)+N(g) ![]() P(g)+Q(g)反应的平衡常数和温度的关系如下:
P(g)+Q(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答:
(1)该反应的平衡常数表达式K=_____________ ,△H_____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的M和0.80mol的N,若反应6s内M的平均反应速率v(M)=0.003 mol·L-1·s-1。,则6s时c(M)=______ mol·L-1, P的物质的量为_______mol;若反应经一段时间后,达到平衡时N的转化率为______。
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(M)不随时问改变 d.单位时间里生成P和Q的物质的量相等
(4)1200℃时反应P(g)+Q(g) ![]() M(g)+N(g)的平衡常数的值为______________。
M(g)+N(g)的平衡常数的值为______________。