题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
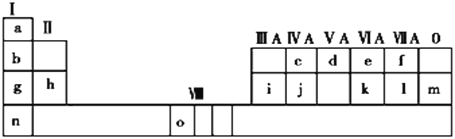
试回答下列问题:
(1)请写出元素o的基态原子电子排布式_______。
(2)d的氢化物的分子构型为_____;k在空气中燃烧产物的中心原子的杂化形式为____,该分子是______(填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是_____(填具体物质),试从结构角度加以解释______
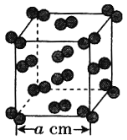
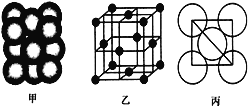
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为______。
②该晶体的密度为______ (用字母表示)。
【答案】1s22s22p63s23p63d64s2 三角锥形 sp2 极性 SiC 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C—Si键键长比晶体Si中Si—Si键长短,键能大,因而熔沸点高 12 ![]()
【解析】
(1)根据o在元素周期表中的位置,o为Fe,核外电子排布式为: 1s22s22p63s23p63d64s2 ;
(2)d元素为N,氢化物为NH3,中心原子N的价层电子对数为![]() ,有1对孤电子对,所以空间构型为三角锥形;k为硫,在空气中燃烧产物为SO2,中心原子S的价层电子对数为
,有1对孤电子对,所以空间构型为三角锥形;k为硫,在空气中燃烧产物为SO2,中心原子S的价层电子对数为![]() ,则中心原子的杂化形式为sp2;SO2有2个σ键,孤电子对数为(6-2×2)/2=1,因此SO2空间构型为V型,分子不对称,正负电中心不重合,SO2属于极性分子;
,则中心原子的杂化形式为sp2;SO2有2个σ键,孤电子对数为(6-2×2)/2=1,因此SO2空间构型为V型,分子不对称,正负电中心不重合,SO2属于极性分子;
(3)j为硅,c为碳,由j原子跟c原子以1∶1形成的化合物为SiC,SiC属于原子晶体,键长:C—Si键<Si—Si键,键能:C—Si键>Si—Si键,原子晶体键长越长、键能越小,熔沸点越低,因此SiC的熔点高;
(4) ①i为Al,根据图乙,Al原子处于晶胞顶点及面心位置,以上面面心Al作为研究对象,同一层上四个角,加上下面4个面中心四个,和上面4个面对应的4个,共有12个Al,所以晶胞中距离Al原子最近的铝原子有12个,即Al的配位数为12;
②根据图乙,铝原子位于顶点和面心,原子个数为8×1/8+6×1/2=4,则晶体的质量为4×M/NAg,根据图丙,原子半径为d,则根据图丙计算晶胞的边长为![]() ,则晶胞的体积为(
,则晶胞的体积为(![]() )3,根据密度的定义ρ=m/V,则密度为:
)3,根据密度的定义ρ=m/V,则密度为:![]() 。
。