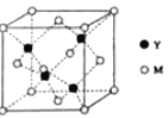
题目内容
【题目】25℃时,有下列四种溶液,下列说法正确的是
① | ② | ③ | ④ |
0.1mol/L的氨水 | pH=11的氨水 | 0.1mol/L的盐酸 | pH=3的盐酸 |
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都成酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值变小
的值变小
D. 将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+)
【答案】D
【解析】试题分析:pH=11的氨水,其c(OH-)=0.001mol/L,pH=3的盐酸,其c(H+)=0.001mol/L.A.①稀释到原来的100倍后,其浓度变为0.001mol/L,因一水合氨是弱电解质,故溶液中c(OH-)小于0.001mol/L,故pH小于11,与②不同,A不正确;B. 等体积①③混合后两者恰好反应生成氯化铵,氯化铵水解使溶液呈酸性,等体积②④混合所得的溶液因氨水过量而使溶液呈碱性,B不正确;C. ①②中分别加入少量CH3COONa固体,![]() 的值不变,因CH3COONa水解使溶液碱性增强,故
的值不变,因CH3COONa水解使溶液碱性增强,故![]() 变大,
变大,![]() 的值变大,C不正确;D. 将20mL的①溶液与10mL的③溶液混合后得到物质的量浓度相同的氨水和氯化铵溶液,若溶液呈碱性,则一水合氨的电离程度大于铵根离子的水解程度,故溶液中离子浓度由大到小为c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+),D正确。本题选D。
的值变大,C不正确;D. 将20mL的①溶液与10mL的③溶液混合后得到物质的量浓度相同的氨水和氯化铵溶液,若溶液呈碱性,则一水合氨的电离程度大于铵根离子的水解程度,故溶液中离子浓度由大到小为c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+),D正确。本题选D。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目