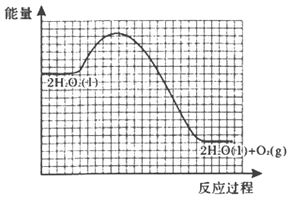
题目内容
【题目】实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(![]() )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是____________(填分子式)。产生这种结果的主要原因是____________________________________________
(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂_________,作用是_____________________。
②装置D加入的试剂_________,装置F加入的试剂_____________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是______________________________________。
④U型管G的作用为_______________________________________.
【答案】H2 随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2 Zn+H2SO4===ZnSO4+H2↑ NaOH溶液(或KMnO4,其它合理答案也给分) 除去混合气体中的SO2 浓硫酸 无水硫酸铜 装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色 防止空气中H2O进入干燥管而影响杂质气体的检验
【解析】
(1) 随着反应Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O的进行,硫酸消耗同时水增加会导致浓硫酸变成稀硫酸,此时就会发生副反应Zn+H2SO4===ZnSO4+H2↑,因此会产生杂质气体H2,故答案为H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2, Zn+H2SO4===ZnSO4+H2↑;
ZnSO4+SO2↑+2H2O的进行,硫酸消耗同时水增加会导致浓硫酸变成稀硫酸,此时就会发生副反应Zn+H2SO4===ZnSO4+H2↑,因此会产生杂质气体H2,故答案为H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2, Zn+H2SO4===ZnSO4+H2↑;
(2)①装置B中加入的试剂主要是为了除去产生混合气体中的SO2,再验证有氢气产生,故答案为NaOH溶液(或KMnO4,其它合理答案);除去混合气体中的SO2;
②装置D加入的试剂目的是除去水,以避免水蒸气对后续反应检验的干扰,故答案为浓硫酸;装置F加入的试剂的目的为检验E处反应是否产生水,所以用无水硫酸铜确定氧化铜来检验,故答案为无水硫酸铜;
③可证实混有氢气的实验现象是氧化铜被还原,同时F中检测到水,故答案为装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色;
④因为F中检测到水才能确定混合气体中有氢气,因此要防止空气中防止空气中H2O进入干燥管而影响杂质气体的检验,故答案为防止空气中H2O进入干燥管而影响杂质气体的检验。

【题目】25℃时,有下列四种溶液,下列说法正确的是
① | ② | ③ | ④ |
0.1mol/L的氨水 | pH=11的氨水 | 0.1mol/L的盐酸 | pH=3的盐酸 |
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都成酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值变小
的值变小
D. 将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+)