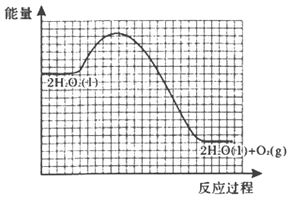
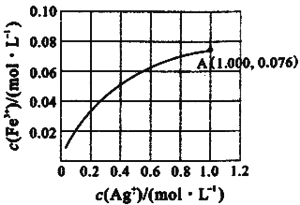
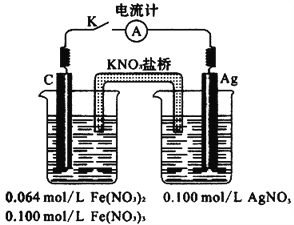
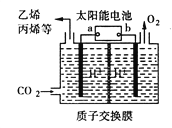
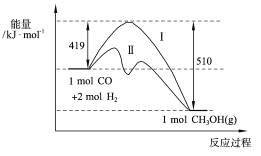
题目内容
【题目】35Cl和 35Cl- 两种微粒中,不同的是
A. 核内质子数 B. 核外电子层数 C. 核内中子数 D. 核外电子数
【答案】D
【解析】试题分析:A.35Cl和35Cl-都是由氯元素形成的微粒,核内质子数均是17,A项不符,B.氯原子最外层有7个电子,得到一个电子形成8电子的稳定结构,核外电子层数没变,B项不符;C.根据核内中子数=质量数-核内质子数,两微粒的质量数相同,质子数也相同,则核内中子数也相同,C项不符;D.氯原子核外有17个电子,而Cl-核外有18个电子,D项符合;答案选D。

【题目】25℃时,有下列四种溶液,下列说法正确的是
① | ② | ③ | ④ |
0.1mol/L的氨水 | pH=11的氨水 | 0.1mol/L的盐酸 | pH=3的盐酸 |
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都成酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值变小
的值变小
D. 将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+)
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过査阅资料找到一种废钒催化剂的回收工艺流程路线如下:

可答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则V2O5转化为VO2+ 的离子方程式为______________。 “废渣1”的主要成分是_______。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式_______________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有_____________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉淀的化学方程式__________ 。