题目内容
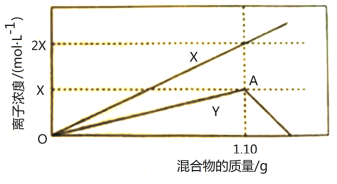
【题目】某同学向100mL NH4Al(SO4)2溶液中加入0.1 mol·L-1NaOH溶液,产生沉淀的图像如下:
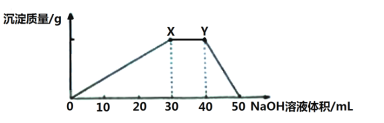
下列说法不正确的是
A.NH4Al(SO4)2溶液中含0.003 mol Al3+
B.NH4Al(SO4)2溶液中NH4+的浓度是0.01 mol·L-1
C.Al3+结合OH-的能力比NH4+强
D.Y点之后发生反应的离子方程式是:Al(OH)3+ OH-= AlO2-+2H2O
【答案】A
【解析】
向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,首先生成氢氧化铝沉淀。当铝离子恰好沉淀完后,此时对应X点;继续加入氢氧化钠,铵根开始转化为一水合氨,铵根恰好完全转化为一水合氨,此时对应Y点。继续加入氢氧化钡,则氢氧化铝开始溶解,最终完全溶解。
A. Y点之后氢氧化铝开始溶解,共消耗0.01L×0.1 mol·L-1=0.001molNaOH,根据反应Al(OH)3 + NaOH = NaAlO2 + 2H2O可知,n(Al(OH)3)=n(NaOH)=0.001mol,故A错误;
B. X点后继续加入氢氧化钠,铵根开始转化为一水合氨,铵根恰好完全转化为一水合氨,此时对应Y点,共消耗0.01L×0.1 mol·L-1=0.001molNaOH,根据反应NH4++OH-=NH3H2O可知,n(NH4+)=n(NaOH)=0.001mol,故B正确;
C. Al3+先和氢氧根反应生成沉淀,则Al3+结合OH-的能力比NH4+强,故C正确;
D. Y点后继续加入氢氧化钡,则氢氧化铝开始溶解,最终完全溶解,离子方程式为:Al(OH)3+ OH-= AlO2-+2H2O,故D正确;
题目要求选择不正确的,故选A。