题目内容
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
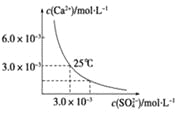
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
【答案】
(1)![]()
(2) 2MoS2 + 7O2 = 2MoO3 +4 SO2(高温)
(3)MoO3+Na2CO3== Na2MoO4+CO2↑
(4) MoS2+9ClO-+6OH-== MoO42-+9Cl-+2SO42-+3H2O
(5) (NH4)2CO3、(NH4)2SO3
(6) ①1:1 ②常温下浓硫酸具有强氧化性,会使铁钝化,③Cl-有利于碳素钢的腐蚀,SO42-不利于碳素钢的腐蚀
(7)nMoS2 + xLi+ + xe- = Lix(MoS2)n
【解析】
试题分析:(1)离子化合物NaClO的电子式为![]() ;
;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
(3)途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(5)CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢。
(7)电池放电时正极发生还原反应,电极反应式是nMoS2 + xLi+ + xe- = Lix(MoS2)n。