题目内容
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂。
已知:氯化铜容易潮解.

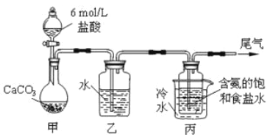
I.实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜。
(1)石棉绒的作用是 ;B装置中的试剂是 。E和F装置及试剂可用_______ 替换(填装置及所装试剂)。
(2)当Cl2排尽空气后,加热D。则D中发生反应的化学方程式为 。
(3) 若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是 (一种即可)。
Ⅱ.另取纯净CuC l2固体用于制备CuCl。
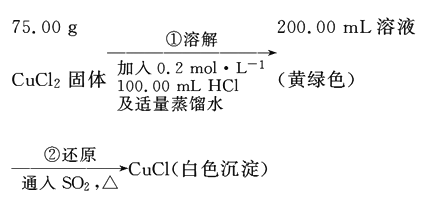
(4)溶解时加入HCl溶液的目的主要是 (结合离子方程式回答)。
(5)若接上述操作用10. 0mol/L的HCl代替0.2mol/L HCl,通人SO2后,200. 00mL黄绿色溶液颜色褪去,但无白色沉淀。对此现象:
甲同学提出假设:c(H+)过大。
为验证此假设,可取75.00g CuCl2固体与100mL0.2mol/LHCl及 mL9. 8mol/LH2SO4配制成200. 00mL溶液再按上述操作进行实验。
乙同学查阅资料:体系中存在平衡2Cl-(aq)+CuCl(s)=CuCl32-(aq)。则出现此现象另一可能的原因是 。
【答案】(1)增大铜粉与氯气的接触面积,和NaCl溶液,装有碱石灰(或生石灰)的干燥管
(2)Cu+Cl2![]() CuCl2
CuCl2
(3) 石棉绒(Cu或CuCl)
(4)Cu2++2H2O![]() Cu(OH)2+2H+, 加酸抑制Cu2+的水解
Cu(OH)2+2H+, 加酸抑制Cu2+的水解
(5)50 ,(Cl-) 过大
【解析】试题分析:I.(1)石棉绒的作用是增大铜粉与氯气反应的接触面积;氯气有毒,所以B装置是吸收尾气,而氯气用氢氧化钠吸收,故答案为:增大铜粉与氯气反应的接触面积;NaOH溶液;
(2)当Cl2排尽空气后,加热A,铜与氯气反应生成氯化铜,化学反应方程式为:Cu+Cl2![]() CuCl2;(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种;
CuCl2;(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种;
Ⅱ.(4)因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2OCu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解;
(5)设9.8mol/LH2SO4的体积为VmL,则0.2×0.1+V×9.8×2=10×0.1,解之得V=50ml,体系中存在平衡2Cl-(aq)+CuCl(s)CuCl32-(aq),是氯离子的浓度过大平衡正向移动。