题目内容
【题目】碘和铁均是人体必需的微量元素。
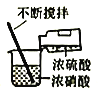
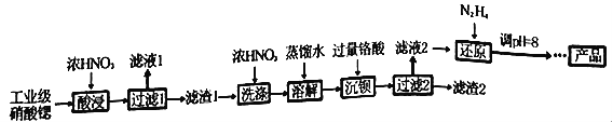
(1)海带中含有丰富的以碘离子形式存在的碘元素。在实验室中,从海藻中提取碘的流程如下:

①上述流程中涉及下列操作,其中错误的是________________(填标号)。
A.将海藻灼烧成灰
B.过滤含I-溶液
C.下口放出含碘的苯溶液
D.分离碘并回收苯
②写出步骤④发生反应的离子方程式:_______________________________________
③要证明步骤④所得溶液中含有碘单质,可加入___________________(填试剂名称),观察到________________________(填现象)说明溶液中存在碘。
(2)探究铁与稀硝酸的反应。用5.6gFe粉和含有0.3 mol HNO3的稀硝酸进行实验,若两种物质恰好完全反应,且HNO3只被还原成NO。回答下列问题:
①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为___________________________________
②反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=_________________。
③标准状况下,生成NO气体的体积为_________________L(保留两位小数)。
【答案】AC H2O2+2I-+2H+=I2+2H2O 淀粉溶液 溶液变蓝 Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O 1:3 1.68
【解析】
(1)①A. 固体的灼烧应在坩埚中进行,因此将海藻灼烧成灰,应在坩埚中进行,A错误;
B. 过滤时,应用玻璃棒引流,B正确;
C. 含碘的苯溶液的密度比水小,在上层,分液时,上层液体从分液漏斗的上口到出,C错误;
D. 分离回收苯时,应采用蒸馏装置,D正确;
故选AC;
②步骤④中的过氧化氢将I-氧化成I2,结合得失电子守恒、电荷守恒和原子守恒,可得方程式H2O2+2I-+2H+=I2+2H2O;
③根据淀粉遇碘变蓝的性质,证明步骤④所得溶液中含有碘单质,应加入淀粉溶液,若能观察到溶液变蓝色,则证明溶液中含有碘单质。
(2)①铁与硝酸反应生成硝酸铁、一氧化氮和水,反应过程中,Fe由0价变为+3价,N由+5变为+2,因此Fe和NO的系数都为1,再根据原子守恒进行配平,配平后的化学反应方程式为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;
②5.6g铁的物质的量![]() ,0.1molFe与0.3mol硝酸反应,硝酸完全反应,结合方程式Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O可知,消耗掉的Fe的物质的量
,0.1molFe与0.3mol硝酸反应,硝酸完全反应,结合方程式Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O可知,消耗掉的Fe的物质的量![]() ,反应生成的硝酸铁的物质的量为0.075mol,则还剩余0.025mol的Fe与三价铁离子发生反应Fe+2Fe(NO3)3=3Fe(NO3)2,则参与反应的硝酸铁的物质的量为0.05mol,生成硝酸亚铁的物质的量为0.075mol,反应后溶液中剩余的硝酸铁为0.025mol,因此反应后所得溶液中
,反应生成的硝酸铁的物质的量为0.075mol,则还剩余0.025mol的Fe与三价铁离子发生反应Fe+2Fe(NO3)3=3Fe(NO3)2,则参与反应的硝酸铁的物质的量为0.05mol,生成硝酸亚铁的物质的量为0.075mol,反应后溶液中剩余的硝酸铁为0.025mol,因此反应后所得溶液中![]() ;
;
③0.3mol硝酸完全反应后生成NO的物质的量为0.075mol,该气体在标况下的体积![]() 。
。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L