题目内容
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=___________。
(2)关于反应①下列说法,正确的是___________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如下图所示:

①从反应开始到5min时,生成甲醇的平均速率为___________。
②H2的平衡转化率α=___________%,化学平衡常数K=___________。
③1min时,υ正___________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正___________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小_________________________________。
③若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数___________0.1。(填“>”、“<”或“=”)
【答案】-63 kJ·mol-1 CD 0.025 mol·L-1·min-1 25 0.59 大于 大于 υ (12~13)>υ(7~8)=υ(25~27) <
【解析】
(1)反应热=反应物总键能-生成物总键能;
(2)A、△G=△H-T△S<0反应才能自发;B、升高温度,正逆反应速率均增大;C、使用催化剂,不改变平衡;D、平衡常数与温度有关;
(3)根据三段式解析。①由速率的定义式计算;②根据转化率和平衡常数表达式计算;③反应正向进行时,正速率大。④平衡之前,正速率大于逆速率;⑤平衡时平均速率为0;⑥绝热条件,放热反应发生后体系温度升高。
(1)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应△H2=2×803kJ·mol-1+3×436kJ·mol-1-(3×413+343+465)kJ·mol-1-2×465kJ·mol-1=-63 kJ·mol-1 ;
CH3OH(g)+H2O(g),该反应△H2=2×803kJ·mol-1+3×436kJ·mol-1-(3×413+343+465)kJ·mol-1-2×465kJ·mol-1=-63 kJ·mol-1 ;
(2)①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
A.△H1=-99kJ·mol-1,△S<0,△G=△H-T△S,该反应在低温下可能自发进行,故A错误;
B.升高温度,正反应速率增大,逆反应速率也增大,故B错误;
C.使用催化剂,不改变平衡,不能提高CO的转化率,故C正确;
D.平衡常数与温度有关,增大压强,该反应的化学平衡常数不变,故D正确;
故选CD。
(3)根据题目数据计算如下:
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始/mol·L-1: 0.5 1 0
反应/mol·L-1: X 2X X
平衡/mol·L-1: 0.5-X 1-2X X
甲醇的物质的量分数为![]() =10%,所以 X=0.125mol·L-1。
=10%,所以 X=0.125mol·L-1。
①甲醇的速率为0.125mol·L-1÷5min=0.025 mol/(L·min)。
②由上述计算,反应的氢气为2×0.125 mol·L-1=0.25 mol·L-1,转化率为0.25 mol·L-1÷1 mol·L-1=25%。达平衡时CO、H2和CH3OH的物质的量浓度分别为:0.375mol·L-1、0.75mol·L-1和0.125mol·L-1,所以平衡常数K=0.125/(0.375×0.752)=0.59。
③1min时,没有达到平衡,甲醇的浓度增大,反应正向进行,υ正>υ逆;
④反应达平衡的速率图像如下图:
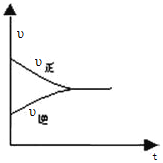
所以,在达平衡前任意点的正反应速率大于任意点的逆反应速率,即1min时的υ正(CH3OH)>4min 时υ逆(CH3OH )。
⑤12~13min处于非平衡状态,反应速度大,甲醇在7~8min、25~27min处于平衡状态,平均反应速率为0,甲醇在7~8min、12~13min和25~27min时平均反应速率的大小:υ(12~13)>υ(7~8)=υ(25~27);
⑥若将钢瓶换成同容积的绝热钢瓶,重复上述实验,则反应放出的热量不能散发,会使体系温度上升,正反应放热,温度升高,平衡逆向移动,甲醇体积分数将减小,所以小于0.1。






