题目内容
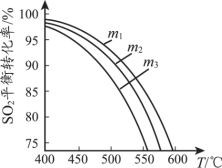
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
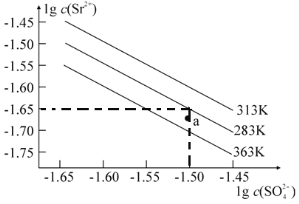
A.283K时,图中a点对应的溶液是不饱和溶液
B.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
C.283 K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D.三个不同温度中,363 K时Ksp(SrSO4)最大
【答案】A
【解析】
A项、由图可知,283 K时Ksp(SrSO4)=c(SO42—)c(Sr2+)=101.5×101.65,而a点时,c(SO42—)=101.5,c(Sr2+)<101.65,所以a点Qc(SrSO4)<Ksp(SrSO4),对应的溶液是不饱和溶液,故A正确;
B项、沉淀溶解平衡常数(Ksp)只受温度影响,温度一定时,Ksp(SrSO4)一定,故B错误;
C项、由图可知,363 K时的Ksp(SrSO4)小于283 K时的Ksp(SrSO4),故283 K下的SrSO4饱和溶液升温到363K后,会析出固体,得到的溶液仍为饱和溶液,故C错误;
D项、由图可知, 313 K时Ksp(SrSO4)最大,D错误;
故选A。

【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 50 | 70 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,碱性增强,该反应的离子方程式为____________________。
(2)乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________ (填“大于”或“小于”)NaHCO3的水解程度。
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH______8.3(填“>”“<”或“=”,下同),说明甲同学正确;若_______8.3,说明乙同学正确。