题目内容
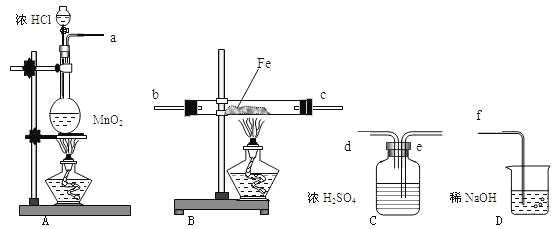
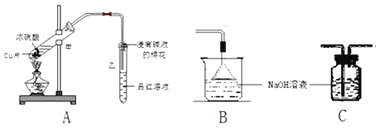
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。

(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
【答案】a C B C2H5OH![]() C2H4↑+H2O 2C2H5OH
C2H4↑+H2O 2C2H5OH![]() C2H5OC2H5+H2O 2HBr+H2SO4(浓)
C2H5OC2H5+H2O 2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O
Br2+SO2↑+2H2O
C2H5OH+2H2SO4(浓)![]() 2C+2SO2↑+5H2O
2C+2SO2↑+5H2O
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(任意选取 3 个反应即可) 将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
CO2↑+2SO2↑+2H2O(任意选取 3 个反应即可) 将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
【解析】
(1)由题给信息,知该反应为:C2H5-OH+HBr![]() C2H5Br+H2O,反应需要加热,所以应采用装置a;
C2H5Br+H2O,反应需要加热,所以应采用装置a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的,V(C2H5OH)=![]() =14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,故答案为C;
=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,故答案为C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出,故答案为B;
(4)可能发生的副反应有:C2H5OH脱水生成乙烯和乙醚;浓H2SO4氧化HBr;C2H5OH脱水炭化等反应.故答案为:C2H5OH![]() C2H4↑+H2O、2C2H5OH
C2H4↑+H2O、2C2H5OH![]() C2H5OC2H5+H2O、2HBr+H2SO4(浓)
C2H5OC2H5+H2O、2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O、C2H5OH+2H2SO4(浓)
Br2+SO2↑+2H2O、C2H5OH+2H2SO4(浓)![]() 2C+2SO2↑+5H2O、C+2H2SO4(浓)
2C+2SO2↑+5H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(任意选取2个反应即可);
CO2↑+2SO2↑+2H2O(任意选取2个反应即可);
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用质量分数小于5%的稀NaOH溶液洗涤除去,采用稀NaOH溶液,是为了防止C2H5Br的水解。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2