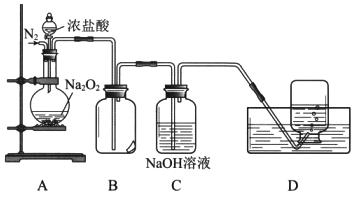
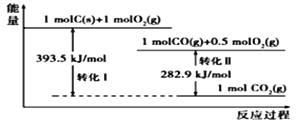
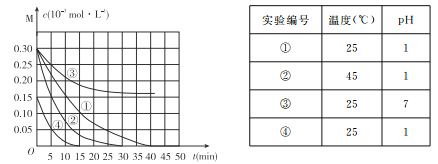
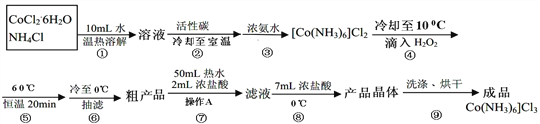
题目内容
【题目】NaCN是重要的基本化工原料,常用于基本化学合成、冶金等,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_________________________________;
(2)现代开采金矿:先以NaCN溶液浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液;再用锌与Na[Au(CN)2]溶液发生置换反应生成金。“粉碎”的目的是______________;“浸取”反应的氧化剂是______________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目:____________________________________________。
【答案】+2![]() 增大接触面积,加快反应速率O21∶2
增大接触面积,加快反应速率O21∶2![]() +2NH3===2NaCN+3H2O
+2NH3===2NaCN+3H2O
【解析】
(1)NaCN中钠离子和氢氰根离子之间存在离子键、C-N原子之间存在共价键;(2)矿石粉碎可以增大反应物的接触面积,加快反应速率,根据题给元素化合价的变化可知,NaCN中各元素的化合价没有变,是空气中的氧气氧化了金,根据电子得失守恒可计算出消耗的锌与生成的金的物质的量之比;(3)纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2。
(1)NaCN中钠元素化合价+1价,氮元素化合价-3价,由化合价代数和为0得关系式:+1+x-3=0,解得x=+2,Na+离子与CN-离子以离子键结合形成离子化合物NaCN,CN-离子中含有碳氮三键,NaCN的电子式为:![]() 。(2)矿石粉碎可以增大反应物的接触面积,加快反应速率;根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2](二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,所以“浸取”反应的氧化剂是氧气,还原得到1mol金要转移1mol电子,1mol锌反应转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2。(3)纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2,电子转移方向和数目为
。(2)矿石粉碎可以增大反应物的接触面积,加快反应速率;根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2](二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,所以“浸取”反应的氧化剂是氧气,还原得到1mol金要转移1mol电子,1mol锌反应转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2。(3)纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2,电子转移方向和数目为![]() +2NH3=2NaCN+3H2O。
+2NH3=2NaCN+3H2O。