题目内容
【题目】根据下图所给信息,得出的结论正确的是( )
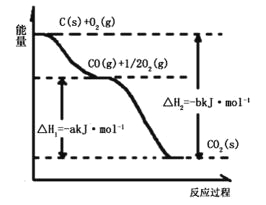
A.碳的燃烧热为bkJ/mol
B.2C(s)+O2(g)=2CO(g)△H=-2(b-a)kJ/mol
C.2CO2(s)=2CO(g)+O2(g)△H=+akJ/mol
D.C(s)+O2(g)=CO2(g)△H<-bkJ/mol
【答案】D
【解析】
试题分析:①C(S)+O2(g)=CO2(s) △H=-b kJ/mol, ② CO(g) +1/2O2(g)=CO2(s) △H = -a kJ/mol; 根据盖斯定律:②×2-①得出2C(s) + O2(g) = 2CO(g) △H = (2 a- b)kJ/mol答案B错误;C(S)+O2(g)=CO2(s) △H=-b kJ/mol,而碳的燃烧热是指生成CO2(g), 所以燃烧热数值大于b kJ,△H< -b kJ/mol因此D正确;

练习册系列答案
相关题目