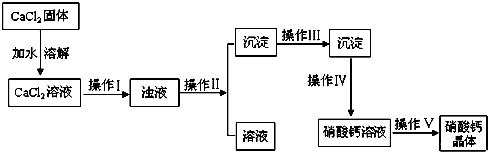
题目内容
18.某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均己略去)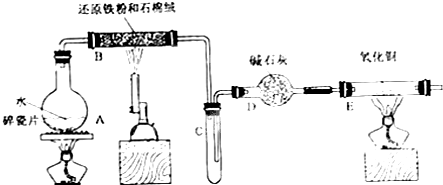
(1)装置B中发生反应的化学方程式是3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+H2.
(2)装置E中的现象是黑色的粉末变成紫红色,管壁产生水珠.
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.简述检验滤液中Fe3+的操作方法:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色.
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图:滤液$→_{Ⅰ}^{Cl_{2}}$FeCl3溶液$\stackrel{Ⅱ}{→}$FeCl3•6H2O晶体
①步骤Ⅰ中通入Cl2的作用是将Fe2+氧化成Fe3+.
②该流程中需保持盐酸过量,主要原因是Fe3++3H2O
 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
分析 (1)铁与水蒸气高温下反应生成四氧化三铁和氢气,据此写出反应的化学方程式;
(2)装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)根据三价铁的检验方法加KSCN溶液,观察是否变红;
(4)①根据流程结合氯气的强氧化性分析氯气的作用;
②由FeCl3稀溶液中得到FeCl3•6H2O晶体需加热浓缩、冷却晶体,过滤;
③由于铁离子易水解,应在酸溶液中加热浓缩,主要是抑制三价铁的水解.
解答 解:(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠,故答案为:黑色的粉末变成紫红色,管壁产生水珠;
(3)检验三价铁用KSCN溶液,观察是否变红,故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,故答案为:将Fe2+氧化成Fe3+;
②由于铁离子易水解,水解方程式为:Fe3++3H2O  Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,
Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,
故答案为:Fe3++3H2O  Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
点评 本题考查了铁及其化合物的性质实验,题目难度不大,注意掌握铁与水蒸气反应原理,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | Br2>Fe3+>I2 | B. | I->Fe2+>Br- | C. | Br2>I2>Fe3+ | D. | Fe3+>I2>Br2 |
| A. | a-b-c-d-e-e-f-g-h | B. | a-e-d-c-b-h-j-g | ||
| C. | a-d-e-c-b-h-j-g | D. | a-c-b-d-e-h-j-f |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
实验③2Na+2H2O=2NaOH+H2↑
实验④Mg+2HCl=MgCl2+H2↑,
实验⑤2Al+6HCl=2AlCl3+3H2↑;
(2)实验结论:同周期从左至右元素金属性减弱,非金属性增强.
| A. | C3H6和C3H8O | B. | C3H4和C2H6 | C. | C3H6O2和C3H8O | D. | C4H6和C3H6O |
| A. | 碳酸的电离方程式:H2CO3?H++CO32- | |
| B. | 少量二氧化硫通入氢氧化钠溶液中的化学方程式:SO2+NaOH═NaHSO3 | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O═H3O++CO32- | |
| D. | 向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |