题目内容
17.根据反应式:①2Fe3++2I-=2Fe2++I2 ②Br2+2Fe2+=2Fe3++2Br-,判断下列粒子的氧化性由强到弱的顺序是( )| A. | Br2>Fe3+>I2 | B. | I->Fe2+>Br- | C. | Br2>I2>Fe3+ | D. | Fe3+>I2>Br2 |
分析 根据反应中元素化合价的降低来分析氧化剂,然后利用氧化剂的氧化性大于氧化产物的氧化性来比较.
解答 解:反应①中Fe元素的化合价由+3降低为+2价,则Fe3+为氧化剂,I元素的化合价从-1价升高为0价,所以I2是氧化产物,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Fe3+>I2,
反应②中Br元素的化合价由0降低为-1价,则Br2为氧化剂,Fe元素的化合价由+2升高为+3价,则Fe3+为氧化剂,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Br2>Fe3+,由以上反应可知氧化性强弱为Br2>Fe3+>I2,
故选A.
点评 本题考查氧化性的比较,明确氧化还原反应中元素的化合价变化及氧化剂的氧化性大于氧化产物的氧化性是解答本题的关键.

练习册系列答案
相关题目
7.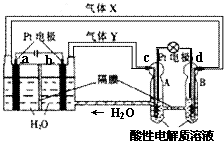 “天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
“天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
 “天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
“天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当转移0.1 mol电子,a极产生2.24 L H2 | |
| B. | b电极反应是:4H2O+4e-═2H2↑+4OH- | |
| C. | d电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上发生还原反应,B中H+经隔膜进入A |
8.环境污染已成为人类社会面临的重大威胁,各种污染数不胜数,下列各项中与环境污染无关的是( )
| A. | 温室效应 | B. | 水华 | C. | 臭氧空洞 | D. | 潮汐 |
5.鉴别下列各组物质所用的试剂或方法不正确的是( )
| A. | 硬水、软水(肥皂水) | B. | 稀盐酸、食盐水(酚酞试液) | ||
| C. | 涤纶、羊毛制品(点燃) | D. | 空气、氧气(带火星的木条) |
12.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

| A. | 所含原子数相等 | B. | 所含氢原子数相等 | ||
| C. | 所含分子数相等 | D. | 气体密度相等 |
9.下列关系式能说明可逆反应N2(g)+3H2(g)?2NH3(g)已达平衡的是( )
| A. | 3v正(N2)=v正(H2) | B. | v正(N2)=v逆(NH3) | C. | 2v正(H2)=3v逆(NH3) | D. | v正(N2)=3v逆(H2) |
6.人体正常的血红蛋白应含Fe2+.若误食外表与食盐相近的亚硝酸盐,则导致血红蛋白中的Fe2+转化成Fe3+而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是( )
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是还原剂 | ||
| C. | 维生素C是氧化剂 | D. | 亚硝酸盐被氧化 |
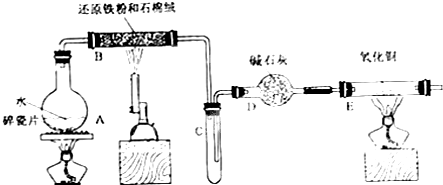
 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).