题目内容
【题目】(14分)安对于工农业生产及国防等都具有重要意义。
(1)工业上以CO2和NH3为原料在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g) ![]() CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
(2)合成氨的原料之一为氢气,以天然气为原料制备氢气的原理如下:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H>0
下列措施一定能使平衡体系中氢气百分含量增大的是______
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.减小压强
(3)T℃时,将1molCO和H2的混合气体与0.2molH2O(g)混合,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
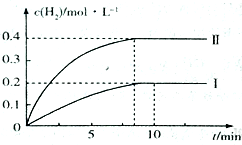
(4)在恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。
CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。

(5)图乙是在一定温度和压强下合成氨反应中H2和N2的起始物质的量之比与NH3平衡体积分数的关系。图中a点的横坐标为______;若按此网站的量之比投料,达到平衡时N2的体积分数为14.5%,则a点的纵坐标为______。
【答案】(1) <(1分);0.8(1分) ;![]() (1分) ;(2)ad (2分) (3)1:4(2分) 441(2分)
(1分) ;(2)ad (2分) (3)1:4(2分) 441(2分)
(4)  (1分);(5)3(2分);42(1分)。
(1分);(5)3(2分);42(1分)。
【解析】
试题分析:(1)升高温度,尿素的产率降低,说明平衡向逆反应方向移动,因此该反应的正反应是放热反应;根据反应方程式可知:每反应产生1mol水,会发生反应消耗1molCO2,2molNH3,则2min达到平衡时反应产生0.8mol水,则反应消耗CO2物质的量是0.8mol,NH3的物质的量是1.6mol,故氨气的反应速率是v(NH3)=1.6mol÷1L÷2min=0.8mol/(L·min);化学平衡常数是可逆反应达到平衡时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,故该反应的化学平衡常数K=![]() ;(2)该反应的正反应是气体体积增大的吸热反应,所以升高温度、减小压强,化学平衡都向正反应方向移动,H2的百分含量一定增大,所以ad正确;增大水蒸气的浓度,化学平衡正向移动,但H2的百分含量不一定增大,b错误;加入催化剂化学平衡不发生移动,c错误。(3)设原混合气体中CO的物质的量为xmol,则
;(2)该反应的正反应是气体体积增大的吸热反应,所以升高温度、减小压强,化学平衡都向正反应方向移动,H2的百分含量一定增大,所以ad正确;增大水蒸气的浓度,化学平衡正向移动,但H2的百分含量不一定增大,b错误;加入催化剂化学平衡不发生移动,c错误。(3)设原混合气体中CO的物质的量为xmol,则
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol) x 0.2 0 1-x
转化(mol) 0.9x 0.9x 0.9x 0.9x
平衡(mol) 0.1x 0.2-0.9x 0.9x 1-0.1x
0.1x+0.9x+1-0.1x=1.18,解得x=0.2,则原混合气体中H2的物质的量为0.8mol,故CO和H2的体积比为1:4,K=![]() ;(4)增大压强,反应速率加快,达到平衡所需要的时间小于10min;由于该反应是反应前后气体分子数不变的反应,所以增大压强化学平衡不发生移动,平衡时氢气的浓度恰好是原平衡的2倍。图像为
;(4)增大压强,反应速率加快,达到平衡所需要的时间小于10min;由于该反应是反应前后气体分子数不变的反应,所以增大压强化学平衡不发生移动,平衡时氢气的浓度恰好是原平衡的2倍。图像为 ;(5)当H2和N2的开始物质的量的比等于方程式中二者的化学计量数之比时,NH3的体积分数最大,故a点的横坐标是3;达到平衡时N2的体积分数为14.5%,则 H2的体积分数为43.5%,所以 NH3的体积分数是1-14.5%-43.5%=42%,即a点的纵坐标是42。
;(5)当H2和N2的开始物质的量的比等于方程式中二者的化学计量数之比时,NH3的体积分数最大,故a点的横坐标是3;达到平衡时N2的体积分数为14.5%,则 H2的体积分数为43.5%,所以 NH3的体积分数是1-14.5%-43.5%=42%,即a点的纵坐标是42。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案