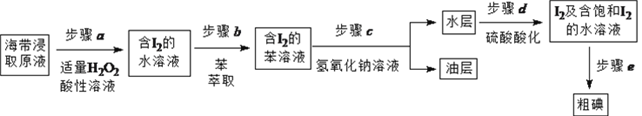题目内容
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子层结构;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______________。(填元素符号),其中C原子的核外电子排布式为__________________________。
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是___________________。A 和B的氧化物所属的晶体类型分别为__________和___________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为______________________。
(4)化合物D2A的立体构型为_____________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为____________________________________。
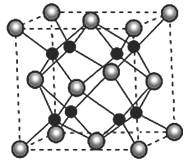
(5)A 和B能够形成化合物F,其晶胞结构如图所示,F的化学式为_____________;晶胞中A原子的配位数为____________________。
【答案】 O 1s22s22p63s23p3(或[Ne] 3s23p3) O3 O3相对分子质量较大,范德华力较大 分子晶体 离子晶体 三角锥形 sp3杂化 V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl) Na2O 8
【解析】已知C核外电子总数是最外层电子数的3倍,可知C的原子序数为15,为![]() ;C和D同周期,D元素最外层有一个未成对电子,D是
;C和D同周期,D元素最外层有一个未成对电子,D是![]() ;A、B原子序数小于C且A的化和价为-2,B为+1,可知A为
;A、B原子序数小于C且A的化和价为-2,B为+1,可知A为![]() ,B为
,B为![]() 。故A为
。故A为![]() ,B为
,B为![]() 。C为
。C为![]() ,D为
,D为![]() 。
。
(1)四种元素中电负性最大的为氧元素,其中磷原子的核外电子排布式为![]() 。
。
(2)A的两种同素异形体为氧气![]() 和臭氧
和臭氧![]() ,其中臭氧的沸点更高,因为二者都是分子晶体,其中臭氧的相对分子质量更大,范德华力更大,因此沸点更高;A的氢化物为水,是分子晶体;B的氢化物为氢化钠,是离子晶体。
,其中臭氧的沸点更高,因为二者都是分子晶体,其中臭氧的相对分子质量更大,范德华力更大,因此沸点更高;A的氢化物为水,是分子晶体;B的氢化物为氢化钠,是离子晶体。
(3)C和D反应生成E的化学式为![]() ,其中磷原子与三个氯原子结合后还有一对孤对电子,故该物质的立体构型为三角锥形,磷的杂化方式为
,其中磷原子与三个氯原子结合后还有一对孤对电子,故该物质的立体构型为三角锥形,磷的杂化方式为![]() 杂化。
杂化。
(4)![]() 的立体构型与水类似,为V形,中心原子氧原子和两个氯原子结合后还有两对孤对电子,和每个氯原子中间又各自形成一个
的立体构型与水类似,为V形,中心原子氧原子和两个氯原子结合后还有两对孤对电子,和每个氯原子中间又各自形成一个![]() 键,故价层电子对数为4;氯气与水和碳酸钠反应制取一氧化二氯的方程式为:
键,故价层电子对数为4;氯气与水和碳酸钠反应制取一氧化二氯的方程式为:![]() 。
。
(5)A和B中,钠离子的半径小于氧离子,故图中大的离子是氧,小的离子是钠,该晶胞中共含有8个钠离子,4个氧离子,最简整数比为![]() ,故该化合物的化学式为
,故该化合物的化学式为![]() ,其中距离每个氧离子最近的钠离子有8个,故其配位数为8
,其中距离每个氧离子最近的钠离子有8个,故其配位数为8

【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
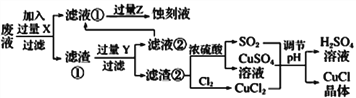
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。