题目内容
【题目】Ⅰ.下列物质中:
(1)互为同分异构体的是______
(2)互为同素异形体的是_______
(3)互为同位素的是__________
(4)属于同一种物质的是______
(5)互为同系物的是__________ (填序号)
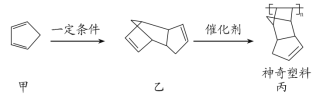
①液氯和氯气 ②白磷和红磷 ③(CH3)3CCH2CH3和(CH3)2CHCH(CH3)2 ④![]() 和
和![]() ⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
Ⅱ.现有6种物质:①MgCl2 ②HCl ③SO2 ④K2CO3 ⑤CaO ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨C2H6 ⑩H2O2
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是_______。
(2)只含离子键的离子化合物是______。
(3)含极性共价键的离子化合物是_________。
(4)含非极性共价键的离子化合物是_________。
【答案】③⑤ ②⑥ ④ ① ⑦ ②③⑨⑩ ①⑤ ④⑥⑧ ⑦
【解析】
Ⅰ.①氯气和液氯是氯气单质的不同单质,属于同一种物质,
②白磷和红磷均属于磷元素形成的不同种单质,互为同素异形体;
③(CH3)3CCH2CH3和(CH3)2CHCH(CH3)2分子式相同,结构不同,互为同分异构体;
④![]() 和
和![]() 质子数相同,中子数不同,是氯元素的不同原子,互为同位素;
质子数相同,中子数不同,是氯元素的不同原子,互为同位素;
⑤(CH3)2CHCH3和CH3(CH2)2CH3分子式相同,结构不同,互为同分异构体;
⑥O2和O3均属于氧元素形成的不同种单质,互为同素异形体;
⑦CH4和CH3CH2CH3结构相似,都属于烷烃,分子组成相差2个CH2原子团,互为同系物;
(1)互为同分异构体的是③⑤,故答案为:③⑤。
(2)互为同素异形体的是②⑥,故答案为:②⑥。
(3)互为同位素的是④,故答案为:④。
(4)属于同一种物质的是①,故答案为:①。
(5)互为同系物的是⑦,故答案为:⑦。
Ⅱ.①MgCl2中镁离子和氯离子之间只存在离子键,属于离子化合物;
②HCl分子中H-Cl原子之间只存在极性共价键,属于共价化合物;
③SO2分子中S与O原子之间只存在极性共价键,属于共价化合物;
④K2CO3中钾离子和碳酸根离子之间存在离子键、O与C原子之间存在极性共价键,属于离子化合物;
⑤CaO中钙离子和氧离子之间只存在离子键,属于离子化合物;
⑥NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性共价键,属于离子化合物;
⑦Na2O2中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性共价键,属于离子化合物;
⑧NH4Cl中铵根离子和氯离子之间存在离子键、N-H原子之间存在极性共价键,属于离子化合物;
⑨C2H6分子中C-H原子之间存在极性共价键,C-C原子之间存在非极性共价键,属于共价化合物;
⑩H2O2分子中O-H原子之间存在极性共价键,O-O原子之间存在非极性共价键,属于共价化合物;
(1)通过以上分析知,属于共价化合物的是②③⑨⑩,故答案为:②③⑨⑩。
(2)只含有离子键的化合物是①⑤,故答案为:①⑤。
(3)含极性共价键的离子化合物是④⑥⑧,故答案为:④⑥⑧。
(4)含非极性共价键的离子化合物是⑦,故答案为:⑦。

【题目】Ⅰ.已知X元素和碳元素同主族,位于周期表中的第1个长周期,是最早使用的半导体材料。短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是XY4。
(1)元素Y原子核外电子有___________种不同运动状态。
(2)X元素原子的价电子的轨道表示式为______________________________.
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(4)该化合物分子为________(填“极性”或“非极性”)分子。
Ⅱ. 已知X、Y为第3周期的两种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
I1 | I2 | I3 | I4 | |
X | 496 | 4562 | 6912 | 9540 |
Y | 577 | 1817 | 2754 | 11578 |
(5)Y单质与X的最高价氧化物对应的水化物反应的化学方程式为:_________。
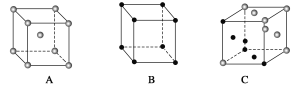
(6)X晶体采用的堆积方式与金属钾相同,X晶体采用下列________(填字母)堆积方式。
(7)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是____________________。