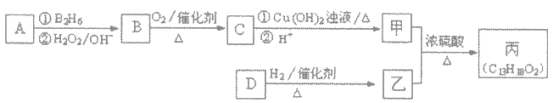
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LSO2溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.分子式为C2H6O的某种有机物4.6g,含有C-H键的数目一定为0.5NA
【答案】A
【解析】
A.铁发生吸氧腐蚀,铁为负极,电极反应为:Fe-2e-=Fe2+,正极反应为:O2+4e-+2H2O=4OH-,Fe2+与OH-反应生成的氢氧化亚铁又被氧气氧化为氢氧化铁,最后变成Fe2O3·xH2O,14.0gFe的物质的量为![]() ,电极反应转移的电子数为0.252NA=0.5NA,A正确;
,电极反应转移的电子数为0.252NA=0.5NA,A正确;
B.标况下,11.2LSO2的物质的量为0.5mol,溶于水生成H2SO3,H2SO3发生两级电离:H2SO3HSO3-+H+、HSO3-SO32-+H+,根据质量守恒定律,溶液中含硫粒子的数目等于0.5NA,B错误;
C.常温下,0.5LpH=14的Ba(OH)2溶液中c(OH-)=1molL-1,OH-数目为0.5L1molL-1=0.5NA,由Ba(OH)2的化学式可知Ba2+的数目为0.25NA,C错误;
D.化学式为C2H6O的有机物可能为乙醇(C2H5OH)或甲醚(CH3OCH3),乙醇(C2H5OH)分子中有5个C-H键,甲醚(CH3OCH3)分子中有6个C-H键,C2H6O的某种有机物4.6g的物质的量为0.1mol,含C-H键数目不一定为0.5NA,D错误。
答案选A。

【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
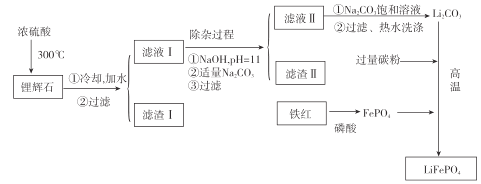
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)①形成的阴离子的结构示意图为___。如果③原子中含8个中子,则其原子符号为___。
(2)③、④、⑤、⑥简单离子半径由小到大的顺序为___。(填离子符号)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___。
(4)设计实验证明⑧的非金属性比⑦强,用化学方程式表示___。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
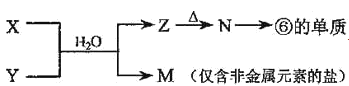
(a)X溶液与Y溶液反应的离子方程式为___。
(b)N→⑥的单质的化学方程式为___。
【题目】Ⅰ.已知X元素和碳元素同主族,位于周期表中的第1个长周期,是最早使用的半导体材料。短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是XY4。
(1)元素Y原子核外电子有___________种不同运动状态。
(2)X元素原子的价电子的轨道表示式为______________________________.
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(4)该化合物分子为________(填“极性”或“非极性”)分子。
Ⅱ. 已知X、Y为第3周期的两种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
I1 | I2 | I3 | I4 | |
X | 496 | 4562 | 6912 | 9540 |
Y | 577 | 1817 | 2754 | 11578 |
(5)Y单质与X的最高价氧化物对应的水化物反应的化学方程式为:_________。
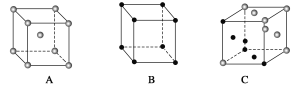
(6)X晶体采用的堆积方式与金属钾相同,X晶体采用下列________(填字母)堆积方式。
(7)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是____________________。