题目内容
8.Ag/(α型)Al2O3是石油化学工业的一种重要催化剂,其中Ag起催化作用,(α型)Al2O3是载体且不溶于硝酸.该催化剂的回收实验如图1所示: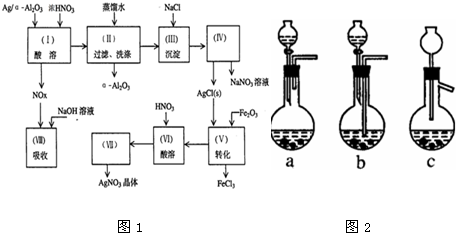
其中(Ⅴ)的转化反应为:6AgCl+Fe2O3=3Ag2O+2FeCl3,(Ⅷ)的吸收反应为:2NaOH+NO2+NO=2NaNO2+H2O
请阅读上述实验流程,完成下列填空:
(1)第(Ⅰ)步:Ag/(α型)Al2O3加酸溶解应该选用图2装置中的a(选填a、b、c).
此处反应的化学方程式为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O;3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O.
(2)第(Ⅱ)步:,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式为:Ag++Cl-=AgCl↓.
(3)第(Ⅵ)步反应的化学方程式为:Ag2O+2HNO3=2AgNO3+H2O.
(4)已知在实验室中AgNO3溶液需要用棕色瓶避光保存.在第(Ⅶ)步中从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为B、E、D(填序号).
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶 F.萃取.
分析 由于α-Al2O3不溶于稀硝酸,Ag/a-Al2O3中加入稀硝酸后银溶解生成硝酸银,过滤后,滤液中含有AgNO3,滤渣为α-Al2O3,滤液中加入NaCl得到沉淀为AgCl,再过滤分离得到AgNO3与NaNO3溶液,AgCl转化为Ag2O,溶解过滤分离,再用硝酸溶解Ag2O得到AgNO3,蒸发浓缩、冷却结晶、过滤等得到AgNO3晶体.
(1)反应生成氮的氧化物气体,需要导出用氢氧化钠溶液吸收,装置应密闭,出气管不能在液面以下;
Ag与浓硝酸反应生成硝酸银、二氧化氮与水,随反应计算,浓硝酸变稀,Ag与稀硝酸反应生成硝酸银、NO与水;
(2)自来水中含有氯气,氯气与水反应生成HCl与HClO,HCl与AgNO3反应生成AgCl与HNO3;
(3)第(Ⅵ)步是Ag2O与HNO3反应生成AgNO3与水;
(4)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作.
解答 解:由于α-Al2O3不溶于稀硝酸,Ag/a-Al2O3中加入稀硝酸后银溶解生成硝酸银,过滤后,滤液中含有AgNO3,滤渣为α-Al2O3,滤液中加入NaCl得到沉淀为AgCl,再过滤分离得到AgNO3与NaNO3溶液,AgCl转化为Ag2O,溶解过滤分离,再用硝酸溶解Ag2O得到AgNO3,蒸发浓缩、冷却结晶、过滤等得到AgNO3晶体.
(1)反应生成氮的氧化物气体,需要导出用氢氧化钠溶液吸收,装置b中产生的气体不能导出,会导致装置内压强增强,发生炸裂的危险,c装置不密闭,故选a;
Ag与浓硝酸反应生成硝酸银、二氧化氮与水,随反应计算,浓硝酸变稀,Ag与稀硝酸反应生成硝酸银、NO与水,反应方程式为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O,
故答案为:a;Ag+2HNO3(浓)=AgNO3+NO2↑+H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O;
(2)自来水中含有氯气,氯气与水反应生成HCl与HClO,HCl与AgNO3反应生成AgCl与HNO3,反应离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓;
(3)第(Ⅵ)步是Ag2O与HNO3反应生成AgNO3与水,反应方程式为:Ag2O+2HNO3=2AgNO3+H2O,
故答案为:Ag2O+2HNO3=2AgNO3+H2O;
(4)从AgNO3溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,顺序为BED,
故答案为:B、E、D.
点评 本题考查制备方案工艺流程、物质的分离提纯、对原理的分析理解等,关键是明确工艺流程中每一步中的试剂、操作与原理,是对学生综合能力的考查,难度中等.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 18gD2O中含的质子数为9 NA | |
| B. | 1.00molNaCl中,所有Na+的最外层电子总数为10×6.02×1023 | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 1molNa 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
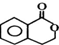
| A. | 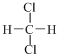 和 和 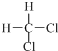 | B. | 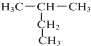 和 和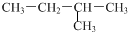 | ||
| C. | CH3CH2CH3和CH2=CHCH3 | D. | 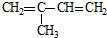 和 和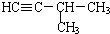 |
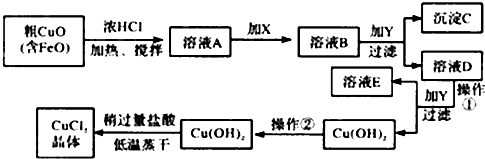
请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
| A. | 硅单质广泛用于制作光导纤维 | |
| B. | SO2使氯水褪色,说明SO2具有漂白性 | |
| C. | 氯气泄漏后应顺风向低处跑 | |
| D. | 酸雨的pH值小于5.6 |
| A. | 相对分子质量相同而结构不同的化合物互称为同分异构体 | |
| B. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| C. | 同分异构体之间由于分子组成相同,所以它们的性质相同 | |
| D. | 只有少数的有机物之间存在同分异构现象 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
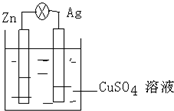 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.