题目内容
【题目】球形纳米银粉是一种重要的无机功能材料,被广泛应用于装饰材料、电接触材料、感光材料、催化剂、医药和抗菌材料等众多领域。从含Ag+的废定影液中回收并制备球形纳米银粉工艺流程图如下:

请回答下列问题:
(1)硝酸中所含元素的原子半径由小到大的顺序:____________;Na在周期表中的位置: _____________;N2H4的电子式:______________。
(2)为使Na2S溶液中![]() 的值减小,可加入的物质是__________。
的值减小,可加入的物质是__________。
A.盐酸 B.适量KOH C.适量NaOH D.适量CH3COONa
(3)写出置换过程的离子反应方程式 _____________________________________。
(4)若氧化精制过程产生等体积的NO2和NO混合气体,写出HNO3与Ag反应的化学反应方程式_____________。
(5)下图分别是HNO3浓度、浸取时间对银回收的影响,则最佳的浓度和时间分别是_____%;___min。


(6)加入N2H4·H2O还原前要将AgNO3溶液的pH调节至5~6,得到Ag的产率最高,pH>6时,银的产率降低的原因为__________________________。
(7)常温下,取上述AgNO3溶液滴加到物质的量浓度均为0.2mol/L NaNO2和CaCl2的混合溶液中(忽略溶液体积变化),当AgNO2开始沉淀时,溶液中c(Cl-)=__________mol/L[已知:常温下,Ksp(AgNO2)=2×10-8 ,Ksp(AgCl)=1.8×10-10]
【答案】H<O<N 第三周期第IA族 ![]() B Fe+Ag2S+2H+=2Ag+Fe2++H2S↑ 4Ag+6HNO3=4AgNO3+NO↑+NO2↑+3H2O 30 6 pH过大会有AgOH生成,降低产品的纯度 1.8×10-3
B Fe+Ag2S+2H+=2Ag+Fe2++H2S↑ 4Ag+6HNO3=4AgNO3+NO↑+NO2↑+3H2O 30 6 pH过大会有AgOH生成,降低产品的纯度 1.8×10-3
【解析】
(1)硝酸分子式是HNO3,在该物质中含H、N、O三种元素,根据元素周期律:原子核外电子层数越多,原子半径越大,当原子核外电子层数相同时,原子序数越大,原子半径越小,因此这三种元素的原子半径由小到大的顺序是H<O<N;Na是11号元素,原子核外电子排布为2、8、1,所以Na在周期表中的位置是第三周期第IA族;在N2H4中,N原子最外层有5个电子,两个N原子共用一对电子,每个N原子再与2个H原子形成2对共用电子对,从而使每个原子都达到稳定结构,所以N2H4的电子式是![]() 。
。
(2) Na2S在溶液中存在水解平衡:S2-+H2O![]() HS-+OH-,为使Na2S溶液中
HS-+OH-,为使Na2S溶液中![]() 的值减小,应加入碱来抑制硫离子的水解,但同时又不能增大c(Na+),因此可加入适量KOH,故答案为选项B;
的值减小,应加入碱来抑制硫离子的水解,但同时又不能增大c(Na+),因此可加入适量KOH,故答案为选项B;
(3)根据流程示意图可知置换过程的离子反应方程式为Fe+Ag2S+2H+=2Ag+Fe2++H2S↑;
(4)氧化精制过程中HNO3与Ag反应产生等体积的NO2和NO混合气体,根据电子守恒及原子守恒,可得该反应的化学反应方式为4Ag+6HNO3=4AgNO3+NO↑+NO2↑+3H2O;
(5)由图象可知,Ag回收率达到最大值时硝酸溶液的浓度为30%、浸取时间为6分钟,所以最佳的浓度和时间分别是30%、6min;
(6)加入N2H4H2O还原前要将AgNO3溶液的pH调节至5-6,得到Ag的产率最高,pH>6时,银的产率降低的原因为pH过大时,会发生反应:Ag++OH-=AgOH↓,会有AgOH生成,从而降低了产品的纯度;
(7)AgNO2开始沉淀所需c(Ag+)=![]() =1×10-7mol/L;由溶度积常数Ksp(AgCl)<Ksp(AgNO2)可知知AgNO2开始沉淀,AgCl已经沉淀,此时:c(Cl-)=
=1×10-7mol/L;由溶度积常数Ksp(AgCl)<Ksp(AgNO2)可知知AgNO2开始沉淀,AgCl已经沉淀,此时:c(Cl-)=![]() =1.8×10-3mol/L。
=1.8×10-3mol/L。

【题目】金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2 (如图1)。

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJ·mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_______________。
(2)M是_______(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_______。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中一个苯环的σ键有____个,化合物乙中碳,氧,氮三个原子对应的第一电离能由大到小的顺序为____________。


(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(5)图3中Ti3+可形成配位数为6的空间构型,问它构成的立体构型为______面体。
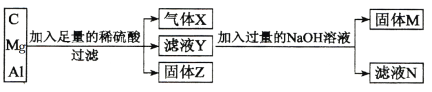
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是____________;
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,________(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应. NO2与水反应的化学方程式为_______________________________;
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为_____________________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
![]()
将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液.NH3与稀硫酸溶液反应的化学方程式为____________________________________________;