题目内容
【题目】金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2 (如图1)。
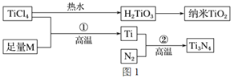
图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJ·mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_______________。
(2)M是_______(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_______。
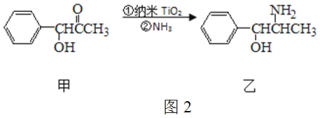
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中一个苯环的σ键有____个,化合物乙中碳,氧,氮三个原子对应的第一电离能由大到小的顺序为____________。
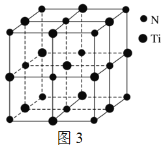
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(5)图3中Ti3+可形成配位数为6的空间构型,问它构成的立体构型为______面体。
【答案】3d24s2 Mg 12 12 N > O >C ![]() 八
八
【解析】
(1)Ti 是22号元素,其原子核外有22个电子,3d、4s电子为其外围电子,根据构造元素书写其外围电子排布式;
(2)M是短周期金属元素,根据其电离能知,该金属位于第IIA族,能还原四氯化钛,说明其金属性较强,为Mg;该金属晶体的堆积模型为六方最密堆积,配位数=3![]() 8
8![]() ;
;
(3) 化合物甲的分子中一个苯环含有7个碳碳键的σ键和5个碳氢单键的σ键;
同一周期元素,随着核电荷数递增,原子半径减小,失电子能力降低,第一电离能增大,但由于N元素原子轨道的半满的结构的能量比较低,导致第一电离能比相邻元素的大;
(4)根据均摊法,可以知道该晶胞中N原子个数为:6![]() +8
+8![]() =4,该晶胞中Ti原子个数为:1+12
=4,该晶胞中Ti原子个数为:1+12![]() ,所以晶胞的质量m=4
,所以晶胞的质量m=4![]() g,而晶胞的体积V=(2a
g,而晶胞的体积V=(2a![]() 10-10)3cm3,所以晶体的密度=
10-10)3cm3,所以晶体的密度=![]() ; (5)由图3可知,Ti3+可形成配位数为6的空间构型,6个N3-构成的立体构型为八面体。
; (5)由图3可知,Ti3+可形成配位数为6的空间构型,6个N3-构成的立体构型为八面体。
(1)Ti为22号元素,原子核外电子排布为1s22s22p63s23p63d24s2,其3d、4s能级上的电子为其价电子,这两个能级上分别含有2个电子,则该原子价电子排布式为3d24s2,
因此,本题正确答案是:3d24s2;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg;Mg晶体属于六方最密堆积,配位数=3![]() 8
8![]() =12;
=12;
因此,本题正确答案是:Mg;12;
(3) 化合物甲的分子中一个苯环含有7个碳碳键的σ键和5个碳氢单键的σ键,共12个σ键;
同一周期元素,随着核电荷数递增,第一电离能增大,但由于N元素原子轨道的半满的结构的能量比较低,导致第一电离能比相邻元素的大,碳,氧,氮三个原子对应的第一电离能由大到小的顺序为N > O >C;
因此,本题正确答案是:12; N > O >C;
(4) 根据均摊法,可以知道该晶胞中N原子个数为:6![]() +8
+8![]() =4,该晶胞中Ti原子个数为:1+12
=4,该晶胞中Ti原子个数为:1+12![]() =4,所以晶胞的质量m=4
=4,所以晶胞的质量m=4![]() g,而晶胞的体积V=(2a
g,而晶胞的体积V=(2a![]() 10-10)3cm3,所以晶体的密度
10-10)3cm3,所以晶体的密度![]() =
=![]() =4
=4![]() g
g ![]() (2a
(2a![]() 10-10)3cm3=
10-10)3cm3=![]() g·cm-3,
g·cm-3,
因此,本题正确答案是:![]() ;
;
(5) 由图3可知,Ti3+可形成配位数为6的空间构型,6个N3-构成的立体构型为八面体,
因此,本题正确答案是:八。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案