题目内容
【题目】已知: 常温下,(1) Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是
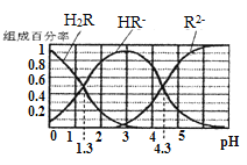
A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
C. 在pH=3的溶液中存在c(R2)×c(H2R)/c2(HR)=10-3
D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
【答案】B
【解析】在PH=4.3的溶液中C(R2)=C(HR-)-
溶液中电荷守恒为:![]() ,
,
所以![]() ,所以A选项是正确的;B.等体积等浓度的NaOH溶液与H2R溶液混合后,生成等物质的量NaHR和
,所以A选项是正确的;B.等体积等浓度的NaOH溶液与H2R溶液混合后,生成等物质的量NaHR和![]() ,溶液中
,溶液中![]() 、
、![]() 浓度相同时,
浓度相同时,![]() ,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,所以B选项是错误的;C.当溶液
,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,所以B选项是错误的;C.当溶液![]() 时,
时,![]() ,则
,则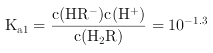 ,溶液的
,溶液的![]() 时,
时,![]() ,则
,则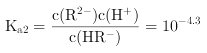 ,
, ,所以C选项是正确的;D.由C选项分析可以知道,
,所以C选项是正确的;D.由C选项分析可以知道,![]() 的电离常数
的电离常数![]() 大于
大于![]() 的
的![]() ,即酸性:
,即酸性:![]() ,所以向
,所以向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]() ,故D正确.所以B选项是正确的.
,故D正确.所以B选项是正确的.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。
【题目】氮及氮的化合物在生产生活中有着重要的用途,NH3、HNQ3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=_______m3,实际消耗了_____kg焦炭。
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示

①与实验a相比,c组改变的实验条件可能是____________。
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为________。
(3)已知N2O4![]() 2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2![]() 2NO+O2 )。在1L的密闭容器中发生反应N2O4
2NO+O2 )。在1L的密闭容器中发生反应N2O4![]() 2NO2达到平衡状态。
2NO2达到平衡状态。
①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色____(和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色______,混合物中NO2的体积分数___________。
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2-]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)