题目内容
【题目】氮及氮的化合物在生产生活中有着重要的用途,NH3、HNQ3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=_______m3,实际消耗了_____kg焦炭。
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
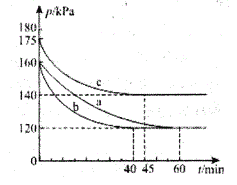
①与实验a相比,c组改变的实验条件可能是____________。
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为________。
(3)已知N2O4![]() 2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2![]() 2NO+O2 )。在1L的密闭容器中发生反应N2O4
2NO+O2 )。在1L的密闭容器中发生反应N2O4![]() 2NO2达到平衡状态。
2NO2达到平衡状态。
①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色____(和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色______,混合物中NO2的体积分数___________。
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2-]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
【答案】 44 30 升高温度 3P0-3P/P0 A A B c[Ag(NH3)2+]/c(Ag+)·c2(NH3) 2.5×10-3 0.045mol
【解析】(1)氮气不参与反应,且空气中![]() 和
和![]() 的体积比为
的体积比为![]() ,则空气中氧气的体积为
,则空气中氧气的体积为![]() ,根据表中知氧气剩余
,根据表中知氧气剩余![]() ,则参与反应的氧气体积为
,则参与反应的氧气体积为![]() ,设水蒸气的体积为
,设水蒸气的体积为![]() ,根据氧元素守恒可知,
,根据氧元素守恒可知,![]() ,由氢元素守恒可知水蒸气的体积为
,由氢元素守恒可知水蒸气的体积为![]() ,即
,即![]() ,则
,则![]() 。
。![]() 和
和![]() 的物质的量为
的物质的量为![]() ,根据碳元素守恒可知实际消耗焦炭的质量为
,根据碳元素守恒可知实际消耗焦炭的质量为![]() 。答案:. 44 30。
。答案:. 44 30。
(2)①a、c开始均通入2molCO和1molSO2,容器的容积相同,而起始时c的压强大于a,物质的量与体积一定,压强与温度呈正比关系,故c组改变的实验条件可能是:升高温度,故答案为:升高温度。
②用p0表示开始的时候的总压强,p表示平衡时的总压强,a表示CO的平衡转化率,则:
2CO(g)+SO2(g)![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
起始量(mol):210
变化量(mol):2aa2a
平衡时(mol):2-2a1-a2a
压强之比等于物质的量之比,则p0:p=3:(2-2a+1-a+2a),整理可得a=![]() ,故答案为:a=
,故答案为:a=![]() ;
;
(3)(2NO2![]() 2NO+O2 )。在1L的密闭容器中发生反应N2O4
2NO+O2 )。在1L的密闭容器中发生反应N2O4![]() 2NO2
2NO2
①根据N2O4![]() 2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。标准状态下(273K 101KPa),加入4.6g纯的NO2,知n(NO2)=0.1mol,部分发生反应,生成N2O4,所以颜色变深;答案:A。
2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。标准状态下(273K 101KPa),加入4.6g纯的NO2,知n(NO2)=0.1mol,部分发生反应,生成N2O4,所以颜色变深;答案:A。
②温度升至25℃,平衡正向移动,向其中加入4.6g纯的NO2,平衡虽然逆向移动,但二氧化氮浓度增大,混合气体颜色变深,因此,本题正确答案是:A.
(4)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,则化学平衡常数![]() 因此,本题正确答案是:
因此,本题正确答案是:![]()
②可逆反应![]()
![]() 的化学平衡常数
的化学平衡常数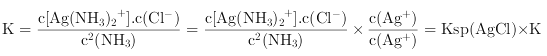 =
=![]()
设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,![]() 根据平衡常数
根据平衡常数![]() X=;0.045mol,
X=;0.045mol,
因此,本题正确答案是: 2.5×10-3 0.045mol

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案