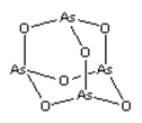
题目内容
【题目】用“>”“<”表示下列各组能级的能量高低。
Ⅰ.(1)4s___3d;
(2)钙是人体所需的重要元素之一,有一种补钙剂——抗坏血酸钙的组成为Ca(C6H7O6)2·4H2O,其结构示意图如下:
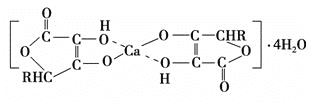
该物质中存在的化学键类型包括________(填字母)。
A.极性共价键 B.离子键 C.非极性共价键 D.配位键
Ⅱ.下列物质中:N2、H2O、Na2O、Ar、H2O2、KOH、NaF、Na2SO4
(1)只含有共价键的物质是______;
(2)只含有离子键的物质是______;
(3)既含有离子键,又含有共价键的物质______;
(4)不存在化学键的是_______。
【答案】< ABCD N2、H2O、H2O2 Na2O、NaF KOH、Na2SO4 Ar
【解析】
Ⅰ.(1)根据构造原理,4s的能量小于3d,本题答案为:<;
(2)由图可知,其中含有离子键,极性共价键,非极性共价键和配位键(虚线表示),因此该物质中存在的化学键类型包括ABCD,本题答案为:ABCD;
Ⅱ. 非金属元素的原子之间通常形成共价键,不同种非金属元素原子之间通常形成极性共价键,同种非金属元素原子之间形成非极性共价键,活泼金属和活泼非金属元素之间易形成离子键。
N2、H2O、H2O2中只含有共价键;Na2O、NaF两种物质都是由简单的阴、阳离子所形成的离子键,它们只含离子键;Na2SO4、KOH中既含离子键、又含共价键,Ar为单原子分子,不存在化学键。
(1)只含有共价键的物质是N2、H2O、H2O2,故本题答案为:N2、H2O、H2O2;
(2)只含有离子键的物质是Na2O、NaF,故本题答案为:Na2O、NaF;
(3)既含有离子键,又含有共价键的物质KOH、Na2SO4,故本题答案为:KOH、Na2SO4;
(4)不存在化学键的是Ar,故本题答案为:Ar。

【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
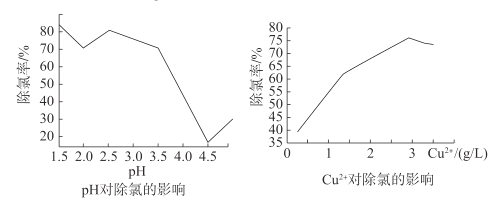
根据图,除去该电解液中Cl-的最佳条件是___。