题目内容
6. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | 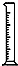 |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
分析 Ⅰ.(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)氢氧化钠要在小烧杯中称量,根据称量固体氢氧化钠所用的仪器来回答;
Ⅱ.(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测得的热量偏小;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高
解答 解:Ⅰ.(1)没有245mL的容量瓶,所以用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
故答案为:5.0;
(2)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙;
故答案为:a b e;
Ⅱ.(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钡钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)4次温度差分别为:4.0℃,4.1℃,3.9℃,4.1℃,4组数据都有效,温度差平均值=$\frac{4.0℃+4.1℃+3.9℃+4.1℃}{4}$=4.0℃;
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376KJ}{0.025mol}$=-53.5 kJ/mol,
故答案为:-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评 本题主要考查溶液的配制、热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

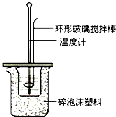
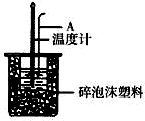 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如右图所示,仪器A的名称是环形玻璃搅拌棒;大小烧瓶间填满泡沫塑料的作用减少实验过程中的热量损失.
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3kJ/(g•℃).
为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1℃ | 终止温度t1℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(4)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.把NaOH溶液迅速倒入盛有稀硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的.
| A. | Al2O3硬度高,熔点2054℃,沸点2980℃,属于原子晶体 | |
| B. | 在晶体中,只要有阴离子一定有阳离子 | |
| C. | 某固态单质能导电,该单质一定属于金属晶体 | |
| D. | SiO2分子中每个Si原子周围有4个O原子,每个O原子周围有2个Si原子 |
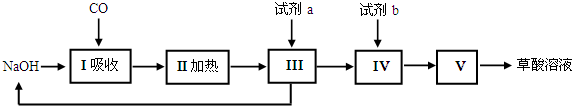
①反应原理:TiO2(s)+CCl4(g) $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③实验装置如图所示:
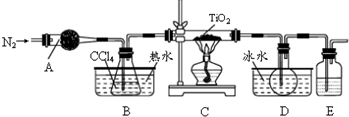
④有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是a(填序号)
a.无水硫酸铜 b.碱石灰 c.氯化钙 d.烧碱
(2)实验整个过程中通入N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行
(3)装置E中的试剂是浓硫酸(写名称),其作用是防止空气中水蒸气、氧气进入.E装置不能(填“能”或“不能”)被A装置代替,原因是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括有:组装仪器、检查装置的气密性、加装药品、通一会儿氮气、最后点燃酒精灯.
(5)制备结束后的操作有:①停止通N2 ②熄灭酒精灯 ③冷却至室温.正确的操作顺序为c(填序号)a.①②③b.③②①c.②③①d.②①③
(6)欲分离D装置中的TiCl4,所采用的实验操作为蒸馏(填操作名称),该实验不可能用到的仪器有d(填序号)a.蒸馏烧瓶 b.接收器 c.直形冷凝管 d.球形冷凝管
温度应控制在76℃,温度计的水银球应插在蒸馏烧瓶的支管口附近,最后得到TiCl4 9.5g.
(7)本实验所得到的TiCl4的产率是b(填序号)
a.40% b.50% c.60% d.70%
| A. | 氧化还原反应:元素化合价是否变化 | |
| B. | 碱性氧化物:是否是金属氧化物 | |
| C. | 电解质和非电解质:溶于水或熔融状态下能否导电 | |
| D. | 同素异形体:是否由同一种原子构成 |
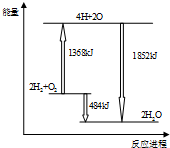
| A. | 拆开2mol H2(g)和1mol O2(g)中的化学键成为H、O原子,共放出1368kJ能量 | |
| B. | 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2molH2(g)和1mol O2(g) 反应生成2mol H2O(l),共吸收484kJ能量 | |
| D. | 2molH2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量 |
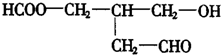 若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
若使X通过化学变化,失去光学活性,可能发生的反应类型有( )①酯化 ②水解 ③氧化 ④还原 ⑤消去.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ③④⑤ | D. | ②③④⑤ |