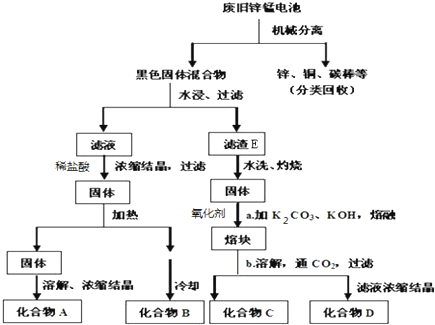
题目内容
19.在下列分子结构中,原子的最外层电子都能满足8电子稳定结构的是( )| A. | H2O | B. | PCl5 | C. | CCl4 | D. | CH4 |
分析 根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数=原子的价层电子数+|化合价|,以此进行分析.
解答 解:A、H2O中,O原子的最外层电子数为6+2=8,H原子的最外层电子数为1+1=2,不都满足8电子稳定结构,故A错误;
B、PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+1=8,不都满足8电子稳定结构,故B错误;
C、CCl4中,C原子的最外层电子数为4+4=8,Cl原子的最外层电子为:7+1=8,都满足8电子稳定结构,故C正确;
D、CH4中,C原子的最外层电子为:4+4=8,H原子的最外层电子数为1+1=2,不都满足8电子稳定结构,故D错误;
故选:C.
点评 本题考查原子核外电子是否满足8电子稳定结构,题目难度不大,注意判断问题的角度.

练习册系列答案
相关题目
10.亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂.某化学兴趣小组进行如下实验.
【实验Ⅰ】用如下装置(已省略夹持装置)制NaNO2.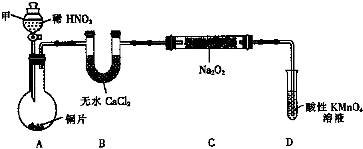
已知:2NO+Na2O2═2NaNO2; 2NO2+Na2O2═2NaNO3
(1)仪器甲的名称是分液漏斗.装置B的作用是干燥NO.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低.为提高NaNO2纯度,需要对上述实验装置的A与B间进行改进,请作图表示其改进措施(图中须标出所用试剂名称)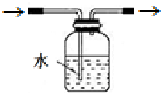 .
.
【实验Ⅱ】利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量.
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0mL并振荡,制成标准色阶.
步骤ii:取1kg泡菜样品,经处理得1L待测液X.
步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为120mg•kg-1
(5)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量.设计并完成下列实验报告.
【实验Ⅰ】用如下装置(已省略夹持装置)制NaNO2.

已知:2NO+Na2O2═2NaNO2; 2NO2+Na2O2═2NaNO3
(1)仪器甲的名称是分液漏斗.装置B的作用是干燥NO.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低.为提高NaNO2纯度,需要对上述实验装置的A与B间进行改进,请作图表示其改进措施(图中须标出所用试剂名称)
 .
.【实验Ⅱ】利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量.
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0mL并振荡,制成标准色阶.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为120mg•kg-1
(5)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量.设计并完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
7.铁元素是维持生命活动不可缺少的微量元素之一.铁的元素符号是( )
| A. | Mg | B. | Ca | C. | Fe | D. | Zn |
14.下列关于有机物的说法正确的是( )
| A. | 乙醇和甘油互为同系物 | |
| B. | 分子式为C7H8O且分子中有苯环的有机物共有4种 | |
| C. | 苯乙烯分子中所有原子可能在同一个平面上 | |
| D. | 测定溴乙烷中的溴元素,加入NaOH溶液加热,冷却后加入AgNO3溶液后有浅黄色沉淀生成 |
4.下列说法正确的是:( )
| A. | 2014年1月4日,国家首次将雾霾天气纳入自然灾情进行通报.雾霾也是一种分散系,分散剂为空气 | |
| B. | 氯化氢溶于水的过程中虽然有H-Cl键的断裂,但没有新化学键的形成,所以该过程是物理过程 | |
| C. | 2014年12月某市某化工市场发生爆炸,据调查为化工原料“醋酸乙烯”燃烧所致,该化工原料属于烯烃 | |
| D. | 2014年的诺贝尔化学奖授予了超高分辨率荧光显微镜的发展者,该技术突破了光学显微镜的极限,能观察到纳米尺度的微粒,该技术还可以将研究反应速率的时间分辨率达到纳秒级水平 |
11.用稀硫酸、氢氧化钠和铝为原料制取氢氧化铝,甲、乙、丙三学生分别用三种不同途径制备.
甲.Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)2$\stackrel{NaOH}{→}$Al(OH)3
乙.Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3
丙.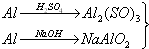 →Al(OH)3
→Al(OH)3
若要制备等量的氢氧化铝,则( )
甲.Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)2$\stackrel{NaOH}{→}$Al(OH)3
乙.Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3
丙.
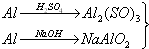 →Al(OH)3
→Al(OH)3若要制备等量的氢氧化铝,则( )
| A. | 乙消耗原料少 | B. | 三者消耗原料相同 | ||
| C. | 丙消耗原料最少 | D. | 甲、乙消耗原料相同 |
8.根据S元素的化合价判断,在下列物质中,S元素只有还原性的是( )
| A. | H2S | B. | S | C. | SO2 | D. | H2SO4 |
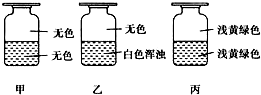 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )